题目内容
 (1)一定条件下,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),向2L密闭容器中通入2mol CO(g)、1mol H2O(g),2min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为
(1)一定条件下,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),向2L密闭容器中通入2mol CO(g)、1mol H2O(g),2min后反应达到平衡时,测得CO的物质的量为1.6mol,用H2O (g)表示该反应速率为(2)在一密闭容器中发生反应2NO2?2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示.
请回答:若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则曲线B此条件可能是
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)?4NO2(g)+O2(g) ②2NO2(g)?2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.3mol/L,则反应②中NO2的转化率为
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)利用三段式计算,根据v=
计算速率,根据平衡常数的定义计算平衡常数的值,根据平衡移动原理,增加一种物的浓度会提高另一种物质的转化率,而自身的转化率下降;
(2)由图象曲线A、B的变化可知,曲线B到达平衡时间较曲线A短,反应速率快,平衡时NO2浓度较曲线A低,转化率高;
(3)设出反应I和反应II产生的氧气的浓度分别为Xmol?L-1,Y mol?L-1,然后依据方程组建立关系求解,得出反应II中NO2的转化率.
| △c |
| t |
(2)由图象曲线A、B的变化可知,曲线B到达平衡时间较曲线A短,反应速率快,平衡时NO2浓度较曲线A低,转化率高;
(3)设出反应I和反应II产生的氧气的浓度分别为Xmol?L-1,Y mol?L-1,然后依据方程组建立关系求解,得出反应II中NO2的转化率.
解答:
解:(1)利用三段式计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol) 2 1 0 0
转化(mol) 0.4 0.4
平衡(mol) 1.6 0.6 0.4 0.4
v(H2O)=
=
=0.1mol/(L.min)
K=
=
=0.1667,
CO转化率为
×100%=20%
根据平衡移动原理,增加CO的浓度提高水的转化率,而自身的转化率下降所以重新达到平衡后CO转化率小于20%,
故答案为:0.1mol/(L.min);0.1667;<;
(2)该反应为体积减小的吸热反应,增大NO2浓度,反应加快,但NO2转化率降低;增大压强,反应加快,但NO2转化率降低;使用催化剂,反应加快,转化率不变;升高温度,反应加快,平衡向正反应方向移动,NO2转化率增大.故为升高温度,故答案为:升高温度;
(3)2N2O5(g)?4NO2(g)+O2(g)
2X 4Xmol?L-1 Xmol?L-1
2NO2(g)?2NO(g)+O2(g)
2Ymol?L-1 Ymol?L-1
则建立关系:X+Y=1.3;4X-2Y=0.6;解得:X=0.53;Y=0.77;
反应②中NO2的转化率为
×100%=72.6%,故答案为:72.6%.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol) 2 1 0 0
转化(mol) 0.4 0.4
平衡(mol) 1.6 0.6 0.4 0.4
v(H2O)=
| △c |
| t |
| ||
| 2min |
K=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 0.2×0.2 |
| 0.3×0.8 |
CO转化率为
| 0.4 |
| 2 |
根据平衡移动原理,增加CO的浓度提高水的转化率,而自身的转化率下降所以重新达到平衡后CO转化率小于20%,
故答案为:0.1mol/(L.min);0.1667;<;
(2)该反应为体积减小的吸热反应,增大NO2浓度,反应加快,但NO2转化率降低;增大压强,反应加快,但NO2转化率降低;使用催化剂,反应加快,转化率不变;升高温度,反应加快,平衡向正反应方向移动,NO2转化率增大.故为升高温度,故答案为:升高温度;
(3)2N2O5(g)?4NO2(g)+O2(g)
2X 4Xmol?L-1 Xmol?L-1
2NO2(g)?2NO(g)+O2(g)
2Ymol?L-1 Ymol?L-1
则建立关系:X+Y=1.3;4X-2Y=0.6;解得:X=0.53;Y=0.77;
反应②中NO2的转化率为
| 0.77×2mo1?L&;-1 |
| 4×0.53mo1?L&;-1 |
点评:本题主要考查了化学平衡的计算,涉及速率、平衡常数、转化率等知识点,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应属于可逆反应的是( )
| A、H2和O2点燃生成H2O的反应与H2O电解生成H2和O2的反应 |
| B、CuSO4吸水形成晶体蓝矾与蓝矾加热失去水分生成CuSO4 |
| C、Cl2溶于水 |
| D、Na2O溶于水 |
下列说法中不正确的是( )
| A、1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、1 mol臭氧和1.5 mol氧气含有相同的氧原子数 |
| C、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
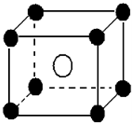 某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析:
某离子晶体晶胞如图所示,阳离子 X(●)位于立方体的顶点,阴离子Y(○)位于立方体的中心,试分析: