题目内容
12.三苯甲醇(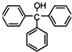 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.已知:(I)格氏试剂容易水解,
 ;
;
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
(1)图2中玻璃仪器B的名称:冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持微沸,可以采用水浴(方式)加热,优点是受热均匀,温度易于控制;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下 提纯方案,请填写如下空白:
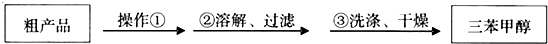
其中,①操作为蒸馏;洗涤液最好选用:A(从选项中选);A、水 B、乙醚 C、乙醇 D、苯
检验产品已经洗涤干净的操作为:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况).产品中三苯甲醇质量分数为90%(保留两位有效数字.
分析 (1)图中玻璃仪器B的名称是冷凝管,由于格氏试剂容易水解,B的作用是防止空气中的水蒸气进入装置;
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,利用水浴加热,受热均匀,便于控制温度;
(3)三苯甲醇粗产品中含有乙醚、溴苯、苯甲酸乙酯等有机物,三苯甲醇的沸点最高,所以先用蒸馏的方法除去有机杂质;碱式溴化镁溶于水,不溶于有机溶剂,所以洗涤液选用水;检查洗涤是否干净,取少量最后一次洗涤液于试管中,用硝酸银溶液检验是否含有溴离子;
(4)由2-OH~H2可计算出三苯甲醇的物质的量,再根据m=nM计算三苯甲醇的质量,进而计算产品中三苯甲醇的质量分数.
解答 解:(1)图中玻璃仪器B的名称是冷凝管,由于格氏试剂容易水解,B的作用是防止空气中的水蒸气进入装置,避免格式试剂水解,故答案为:冷凝管;防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;利用水浴加热,受热均匀,便于控制温度;故答案为:平衡压强,使漏斗内液体顺利滴下;水浴;受热均匀,温度易于控制;
(3)三苯甲醇粗产品中含有乙醚、溴苯、苯甲酸乙酯等有机物,三苯甲醇的沸点最高,所以先用蒸馏或分馏的方法除去有机杂质;由于碱式溴化镁溶于水,不溶于有机溶剂,所以洗涤液选用水,故选A;检查洗涤是否干净的一般步骤是:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净,故答案为:蒸馏或分馏;a;取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净;
(4)由2-OH~H2,可知三苯甲醇的物质的量是$\frac{0.1008L}{22.4L/mol}$×2=0.009mol,所以产品中三苯甲醇的质量是0.009mol×260g/mol=2.34g,则产品中三苯甲醇的质量分数=$\frac{2.34g}{2.60g}$×100%=90%,故答案为:90%.
点评 本题考查有机物合成实验、物质的分离与洗涤等基本操作、对实验装置的分析评价等,较好的考查学生对数据的应用、阅读获取信息的能力以及知识迁移应用,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 混合气的压强不变 | |
| B. | 混合气的体积不变 | |
| C. | 混合气的密度不变 | |
| D. | 有n个H-H键断裂的同时有2n个H-I键断裂 |
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO•Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:
4FeO•Cr2O3(s)+8Na2CO3(s)+7O2=8Na2Cro4(s)+2Fe2O3+8CO2该反应的化学平衡常数的表达式为K=$\frac{c(C{O}_{2})^{8}}{c({O}_{2})^{7}}$,在常温下该反应速度极慢,下列措施中能使反应速率增大的是ABC.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是NaA1O2[或NaA1(OH)4]、Na2SiO3.
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是除去A1O-2、SiO32-等杂质.
④步骤Ⅳ中发生反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O.
(2)将红矾钠与KCl固体按1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.请填写表中空格,完成上述过程.(已知:在室温下重铬酸钾溶解度很小,而在升高温度时,其溶解度大大增加).
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入热的蒸馏水,充分搅拌直到固体不再溶解. |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
| 实验 | 1、将一小块金属钠放入滴有酚酞溶液的冷水中. 2、将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. 3、将一小段镁带投入稀盐酸中. 4、将一小片铝投入稀盐酸中. |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐碱性,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
| A. | 称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,并不断搅拌至固体溶解 | |
| B. | 称取8g NaOH固体,放入100 mL容量瓶中,加入蒸馏水使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8 g NaOH固体,放入100 mL量筒中,加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| D. | 称取8g NaOH固体放入烧杯中,加入适量蒸馏水溶解,冷却后将烧杯中溶液注入100 mL容量瓶后,用少量蒸馏水洗涤烧杯内壁2~3次 |
| A. | 18 | B. | 32 | C. | 14 | D. | 15 |