题目内容
1.配制100mL浓度为2mol/L NaOH溶液过程中,下列部分实验操作正确的是( )| A. | 称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,并不断搅拌至固体溶解 | |
| B. | 称取8g NaOH固体,放入100 mL容量瓶中,加入蒸馏水使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8 g NaOH固体,放入100 mL量筒中,加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| D. | 称取8g NaOH固体放入烧杯中,加入适量蒸馏水溶解,冷却后将烧杯中溶液注入100 mL容量瓶后,用少量蒸馏水洗涤烧杯内壁2~3次 |
分析 配制100mL浓度为2mol/L NaOH溶液所需要的NaOH固体的质量m=CVM=2mol/L×0.1L×40g/mol=8.0g,由于是配制100mL溶液,故只需要将8g氢氧化钠固体放入烧杯中溶解、冷却后移液,然后洗涤、加水定容配制成100mL溶液即可.据此分析.
解答 解:A、称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,溶液体积大于100mL,故A错误;
B、容量瓶不能受热,故不能溶解固体,故B错误;
C、量筒是精密的仪器,不能受热,故不能用于溶解固体或稀释溶液,故C错误;
D、称取8.0g氢氧化钠固体,在烧杯中加水溶解,冷却后转移至100mL容量瓶中,然后洗涤烧杯和玻璃棒2-3次,洗涤液也注入容量瓶中,然后加水定容至凹液面与刻度线相切即可,故D正确.
故选D.
点评 本题考查了如何配制一定物质的量浓度溶液,应注意的是容量瓶和量筒均不能受热,不能用于溶解固体,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列反应中,反应物量的相对多少都会影响反应产物,下列离子方程式正确的是( )
| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:HSO3-+OH-$\frac{\underline{\;△\;}}{\;}$SO32-+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| D. | 含1molKOH的溶液与含2molBa(HCO3)2的溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
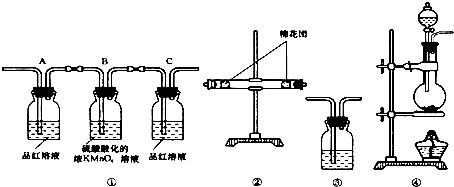
12.三苯甲醇(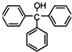 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
已知:(I)格氏试剂容易水解, ;
;

(Ⅱ)相关物质的物理性质如下:
(Ⅲ)三苯甲醇的分子量是260,纯净固体有机物一般都有固定熔点.请回答以下问题:
(1)图2中玻璃仪器B的名称:冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持微沸,可以采用水浴(方式)加热,优点是受热均匀,温度易于控制;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下 提纯方案,请填写如下空白: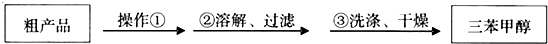
其中,①操作为蒸馏;洗涤液最好选用:A(从选项中选);A、水 B、乙醚 C、乙醇 D、苯
检验产品已经洗涤干净的操作为:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况).产品中三苯甲醇质量分数为90%(保留两位有效数字.
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.已知:(I)格氏试剂容易水解,
 ;
;
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
(1)图2中玻璃仪器B的名称:冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持微沸,可以采用水浴(方式)加热,优点是受热均匀,温度易于控制;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下 提纯方案,请填写如下空白:
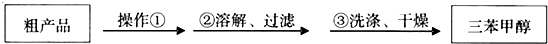
其中,①操作为蒸馏;洗涤液最好选用:A(从选项中选);A、水 B、乙醚 C、乙醇 D、苯
检验产品已经洗涤干净的操作为:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况).产品中三苯甲醇质量分数为90%(保留两位有效数字.
9.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③一个化学反应是放热反应还是吸热反应,决定于反应物和生成物所具有的总能量的相对大小
④化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因.
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③一个化学反应是放热反应还是吸热反应,决定于反应物和生成物所具有的总能量的相对大小
④化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因.
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
6.下列实验操作中所用仪器合理的是( )
| A. | 用 10 m 量筒量取 5.2 mL盐酸 | |
| B. | 用 100 mL量筒量取 5.2 mL盐酸 | |
| C. | 用托盘天平称取25.02g NaCl | |
| D. | 用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
13.与氖的核外电子排布相同的离子跟与氩核外电子排布相同的离子所形成的化合物是( )
| A. | MgBr2 | B. | Na2S | C. | KI | D. | KCl |
10. 已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )
已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )
 已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )
已知A、B、C是单质且C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略).下列A、B间的对应关系,不正确的是( )| A. | A是镁,B是碳 | B. | A是碳,B是氢气 | C. | A是铝,B是铁 | D. | A是钠,B是氢 |