题目内容
如图是周期表中短周期的一部分,A、B的原子序数之和等于C原子的原子序数.下列叙述正确的是( )


| A、C的氧化物对应的水化物一定为强酸,且只有氧化性 |
| B、三种元素对应的氢化物中B的氢化物稳定性最好 |
| C、原子半径大小关系为:B>A |
| D、C的单质常温下为无色无味的气体 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、C属于短周期元素,根据元素在周期表中的位置知,A和B属于第二周期元素、C属于第三周期元素,设A的原子序数是a,则B的原子序数是a+2,C的原子序数是a+9,A、B的原子序数之和等于C原子的原子序数,则a+a+2=a+9,a=7,所以A是N元素、B是F元素、C是S元素,
A.C的氧化物对应的水化物不一定是强酸;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.同一周期元素,其原子半径随着原子序数的增大而减小;
D.C的单质在常温下为固体.
A.C的氧化物对应的水化物不一定是强酸;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.同一周期元素,其原子半径随着原子序数的增大而减小;
D.C的单质在常温下为固体.
解答:
解:A、B、C属于短周期元素,根据元素在周期表中的位置知,A和B属于第二周期元素、C属于第三周期元素,设A的原子序数是a,则B的原子序数是a+2,C的原子序数是a+9,A、B的原子序数之和等于C原子的原子序数,则a+a+2=a+9,a=7,所以A是N元素、B是F元素、C是S元素,
A.C的氧化物对应的水化物不一定是强酸,H2SO3为弱酸且具有还原性,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性B>A>C,所以三种元素对应的氢化物中B的氢化物稳定性最好,故B正确;
C.同一周期元素,其原子半径随着原子序数的增大而减小,所以原子半径大小关系为:B<A,故C错误;
D.C的单质是硫磺,在常温下为固体,故D错误;
故选B.
A.C的氧化物对应的水化物不一定是强酸,H2SO3为弱酸且具有还原性,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性B>A>C,所以三种元素对应的氢化物中B的氢化物稳定性最好,故B正确;
C.同一周期元素,其原子半径随着原子序数的增大而减小,所以原子半径大小关系为:B<A,故C错误;
D.C的单质是硫磺,在常温下为固体,故D错误;
故选B.
点评:本题考查了元素周期表和元素周期律的综合应用,根据原子结构、物质的性质结合元素周期律解答,注意A中C的氧化物的水化物有硫酸和亚硫酸,很多同学往往漏掉亚硫酸而导致错误,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某元素X的气态氢化物的化学式为XH4,则X的最高价氧化物的水化物的化学式为( )
| A、H3XO4 |
| B、H2XO4 |
| C、H2XO3 |
| D、HXO3 |
在分子式为C4H10O的有机物中,含有-OH的同分异构体有(不考虑立体异构)( )
| A、5种 | B、4种 | C、3种 | D、2种 |
下列物质互为同分异构体的是( )
| A、葡萄糖和果糖 |
| B、淀粉和纤维素 |
| C、氧气和臭氧 |
| D、乙烷和丙烷 |
下列关于F、Cl、Br、I性质中,随核电荷数增加而减小(或减弱)的是( )
| A、氢化物稳定性 |
| B、单质的沸点 |
| C、阴离子的还原性 |
| D、最外层电子数 |
下列有关微粒半径大小的比较中,正确的是( )
| A、Na+>F- |
| B、Fe<Fe2+ |
| C、Cl<Cl- |
| D、K+<Ca2+ |
下列元素中,原子半径最大的是( )
| A、O | B、F | C、P | D、Cl |
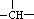 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)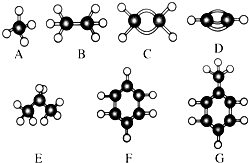 A~G是几种烃的分子球棍模型,据此回答下列问题:
A~G是几种烃的分子球棍模型,据此回答下列问题: 的名称是:
的名称是: