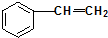题目内容
17.某学生用碱式滴定管量取0.1mol•L-1的NaOH溶液,开始时仰视液面读数为1.0mL,取出部分溶液后,俯视液面,读数为11.0mL,该同学在操作中实际取出的液体体积为( )| A. | 大于10.0mL | B. | 小于10.0mL | C. | 等于10.0mL | D. | 等于11.0mL |
分析 根据滴定管的使用方法和仰视和俯视产生误差的具体情况进行解题,俯视读数偏低,仰视读数偏高.
解答 解:仰视凹液面的最低处时,看到的读数偏大,如果读数为1.00mL,实际小于1.00mL,假设为0.90mL;俯视凹液面的最低处,看到的读数偏小,由凹液面的最低处读数为11.00mL,实际比11.00mL大,假设12.00mL,所以倾出液体的体积是12.00mL-0.90mL=11.1mL,大于10.00m L,
所以A正确,
故选A.
点评 本题考查滴定管的使用,难度不大,注意读数时不能仰视或俯视,视线要与凹液面最低处保持水平;如果仰视或俯视读数时利用假设数值的方法进行解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列有关实验原理或实验操作正确的是( )


| A. | 用水润湿的 pH 试纸测量某溶液的 pH | |
| B. | 用量筒量取 20 mL 0.5000 mol/LH2SO4溶液于烧杯中,加水 80 mL,配制成 0.1000 mol/LH2SO4溶液 | |
| C. | 实验室用图Ⅰ所示装置制取并收集少量氨气 | |
| D. | 实验室用图Ⅱ所示装置除去Cl2中的少量HCl |
5.下列溶液中的离子可以大量共存且无色透明的是( )
| A. | Na+、Fe3+、NO3-、Cl- | B. | K+、HCO3-、SO42-、OH- | ||
| C. | ClO-、Cl-、Na+、OH- | D. | Na+、K+、SiO32-、H+ |
9.下列离子方程式书写正确的是( )
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 以石墨作电极电解氯化铝溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑ | |
| C. | 向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| D. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- |
6.下面常见晶体的叙述中,错误的是( )
| A. | 晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子 | |
| B. | 氯化铯晶体中,Cs+的配位数为8 | |
| C. | 氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个 |
7.有A、B、C、D、E、F六种短周期元素,已知A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示.F的单质可与酸反应,1mol F单质与足量酸反应能产生33.6L H2(标准状况);F的阳离子与A的阴离子核外电子排布完全相同.回答下列问题:
(1)C在周期表中的位置为第三周期第ⅥA族.
(2)元素D的+1价含氧酸的电子式为 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| E | A | |||
| B | C | D |
(2)元素D的+1价含氧酸的电子式为
 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
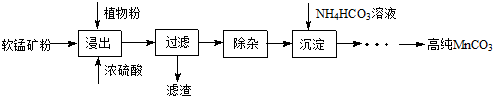
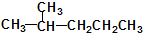 ②
②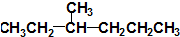 ③
③
 ⑥
⑥