题目内容
12.下列对实验现象的解释与结论正确的是( )| 实验现象 | 解释与结论 | |
| A | 向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解 | 该无色溶液一定是硝酸 |
| B | 将某气体通入品红溶液中,品红溶液颜色 | 该气体一定是SO2 |
| C | SO2气体通过Ba(NO3)2溶液中,溶液出现浑浊现象 | 说明有BaSO3沉淀生成 |
| D | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由淡红色变为红色,冷却后溶液由红色变为淡红色 | 说明HCO3在水溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,说明该无色溶液在酸性条件下具有强氧化性;
B.氯水有漂白性;
C.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-;
D.NaHCO3溶液和酚酞试液的试管,在室温时,溶液为无色,加热时为粉红色,因为碳酸氢根离子水解显碱性,水解过程是吸热过程,加热促进水解,碱性增强.
解答 解:A.向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,说明该无色溶液在酸性条件下具有强氧化性,如硝酸盐等,故A错误;
B.氯水有漂白性,能使品红褪色,故B错误;
C.酸性条件下NO3-与SO2发生氧化还原反应生成SO42-,生成的沉淀为BaSO4,而不是BaSO3,故C错误;
D.溶碳酸氢钠水解生成氢氧化钠和碳酸,加热促进水解平衡正向进行,水解过程是吸热过程,加热促进水解,碱性增强,溶液由浅红色变成红色,冷却后平衡逆向进行,溶液由红色变成淡红色,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及元素化合物知识,侧重于学生的分析、实验能力的考查,为高考常见题型,注意相关基础知识的积累,难度不大.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
18.下列对有机物的命名中,正确的是( )
| A. |  2-甲基丙醇 2-甲基丙醇 | B. |  邻甲基苯酚 邻甲基苯酚 | ||
| C. | CH3CH2OOCCH3 丙酸甲酯 | D. |  2-甲基丙酸 2-甲基丙酸 |
20.下列关于金属的叙述不正确的是( )
| A. | 锡靑铜的熔点比纯铜低 | |
| B. | 锡靑铜文物在潮湿环镜中的腐蚀比干燥环境中快 | |
| C. | 黄铜(铜锌合金}制作的铜锣不易产生铜绿 | |
| D. | 金属的电化学腐蚀必須在酸性条件下进行 |
7.下列有关NaAlO2和Na2S混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Al3+、K+、NO3-可以大量共存 | |
| C. | 向该溶液中滴入少量FeCl3溶液,可能会发生:2Fe3++S2-=2Fe2++S↓ | |
| D. | 向该溶液中同时加入过量的盐酸和过量的Na2SO3溶液,每产生1mol的硫沉淀,转移电子数约为1.024×1024个 |
4.将一小块钠(绿豆大小)投入到饱和石灰水中,不可能观察到的现象是( )
| A. | 溶液变浑浊 | B. | 有无色无味气体生成 | ||
| C. | 钠熔化成闪亮的小球 | D. | 有银白色金属生成 |
1.下列有关实验的说法正确的是( )
| A. | 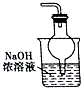 用如图装置除去乙酸乙酯中混有的少量乙酸 | |
| B. | 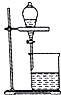 用如图装置可直接分离溴苯和溴 | |
| C. | 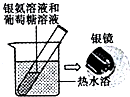 用如图装置验证葡萄糖分子有还原性 | |
| D. | 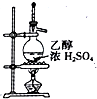 用如图装置制取乙烯 |
2.下列有关“化学与生活、社会”的叙述正确的是( )
| A. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 屠呦呦获得了2015年诺贝尔奖,她用乙醚提取青蒿素的过程属于化学变化 |
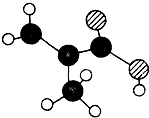 某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等):
某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等):
