题目内容
9.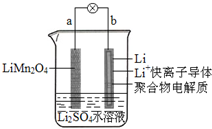 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池放电反应为LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价不发生变化 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |
分析 放电时,Li易失电子作负极,负极反应式为xLi-xe-═x Li+,正极反应式为xLi++Li1-xMn2O4+xe-═LiMn2O4,得失电子相同时将正负极电极反应式相加即可得到电池反应式,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动.
解答 解:A.根据图知,放电时,b电极上Li失电子生成 Li+,所以b是负极,则a是正极,故A正确;
B.放电时,负极反应式为xLi-xe-═x Li+,正极反应式为xLi++Li1-xMn2O4+xe-═LiMn2O4,所以电池反应式为Li1-xMn2O4+xLi=LiMn2O4,故B错误;
C.放电时,a极上Li元素化合价都是+1价,化合价不变,故C正确;
D.a是正极、b是负极,放电时电解质溶液中阳离子向正极移动,所以溶液中的Li+从b向a迁移,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意电解质溶液中阴阳离子移动方向,为易错点.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
20.在指定环境中,下列各组离子一定可以大量共存的是( )
| A. | 25℃,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:ClO-、Cl-、K+、HSO3- | |
| B. | 无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- |
17.普通铜-锌原电池的结构如图,下列有关铜-锌原电池的描述正确的是( )
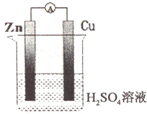

| A. | .锌作负极 | B. | 铜电极上发生氧化反应 | ||
| C. | .铜作负极 | D. | 锌电极上发生还原反应 |
4.下列反应的离子方程式正确的是( )
| A. | 二氧化硫气体通入过氧化钠:2SO2+2Na2O2═2Na2SO3+O2↑ | |
| B. | 金属铝投入NaOH溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| C. | 硫酸亚铁与酸性高锰酸钾反应:3Fe2++MnO${\;}_{4}^{+}$+4H+=3Fe3++MnO2↓+2H2O | |
| D. | 碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
14.某同学采用硫铁矿焙烧取硫后的烧渣 制取七水合硫酸亚铁,设计了如图流程:
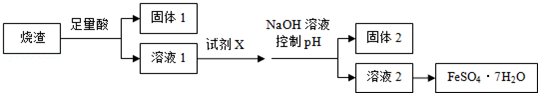
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
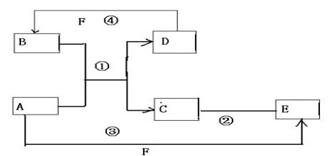
 反应?①的化学方程式2NH3+3Cl2=N2+6HCl
反应?①的化学方程式2NH3+3Cl2=N2+6HCl