题目内容
18.某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O$?_{放电}^{充电}$Fe(OH)2+2Ni(OH)2,下列推断中正确的是( )①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-═Fe+2OH-;
③充电时,Ni(OH)2为阳极;④蓄电池的电极必须浸在某碱性溶液中.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
分析 根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O.
解答 解:①由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故①错误;
②充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,故②正确;
③充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,Ni(OH)2做阳极,故③正确.
④根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,所以电解质溶液是碱,故④正确;
故选D.
点评 本题考查二次电池的工作原理,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应,题目难度中等.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
9.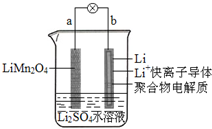 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池放电反应为LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价不发生变化 | |
| D. | 放电时,溶液中的Li+从b向a迁移 |
3.在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)═N2(g)+CO2(g)△H=-213.5kJ mol-1,达到平衡时的数据如下:
下列说法不正确的是( )
| 温度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{9}{16}$ | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 | |
| D. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变 |
10.下列给出几种物质的熔点数据:
回答下列问题:
(1)推测以下几种物质的晶体类型:MgO离子晶体,AlCl3分子晶体,晶体B原子晶体,CCl4分子晶体.
(2)推测晶格能大小:NaCl的晶格能大于(填“大于”或“小于”)KCl的晶格能.经测定NaCl晶体中离子间距为276pm,MgO晶体中离子间距为205pm,MgO的熔点比NaCl的高出很多,其主要原因是电荷数多,晶格能大.
(3)CBr4分子的空间构型是正四面体,导致CBr4的熔点大于CCl4熔点的主要原因是CBr4的相对分子质量大于CCl4的相对分子质量,所以CBr4的熔点大于CCl4熔点.
| NaCl | KCl | MgO | AlCl3 | SiC | 晶体B | CCl4 | CBr | |
| 熔点/℃ | 801 | 772 | 2800 | 190 | 2600 | 2300 | -22.9 | 90 |
(1)推测以下几种物质的晶体类型:MgO离子晶体,AlCl3分子晶体,晶体B原子晶体,CCl4分子晶体.
(2)推测晶格能大小:NaCl的晶格能大于(填“大于”或“小于”)KCl的晶格能.经测定NaCl晶体中离子间距为276pm,MgO晶体中离子间距为205pm,MgO的熔点比NaCl的高出很多,其主要原因是电荷数多,晶格能大.
(3)CBr4分子的空间构型是正四面体,导致CBr4的熔点大于CCl4熔点的主要原因是CBr4的相对分子质量大于CCl4的相对分子质量,所以CBr4的熔点大于CCl4熔点.
9.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )
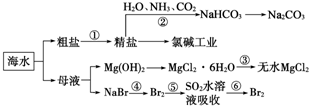

| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |