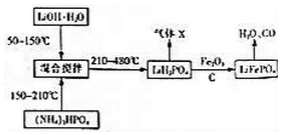
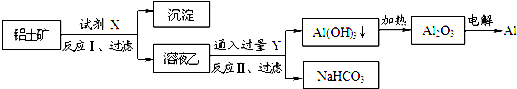
题目内容
17.用氢氧化钾溶液作电解质溶液,写出氢氧燃料电池的电极反应正极:O2+2H2O+4e-=4OH-,负极:2H2+4OH--4e-═4H2O,该电池总反应的方程式为O2+2H2=2H2O.分析 氢氧燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,负极上氢气失电子和氢氧根离子反应生成水,在得失电子相同条件下将正负极电极反应式相加即得电池反应式.
解答 解:氢氧燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,负极上氢气失电子和氢氧根离子反应生成水,在得失电子相同条件下将正负极电极反应式相加即得电池反应式,则正极、负极、电池反应式分别为O2+2H2O+4e-=4OH-、2H2+4OH--4e-═4H2O、O2+2H2=2H2O,
故答案为:O2+2H2O+4e-=4OH-;2H2+4OH--4e-═4H2O;O2+2H2=2H2O.
点评 本题考查电极反应式的书写,为高频考点,侧重考查学生分析判断能力,明确各个电极上发生的反应是解本题关键,注意结合电解质溶液酸碱性书写,如果是酸性条件下,则负极上生成氢离子,正极上生成水.

练习册系列答案
相关题目
7.在一定温度下,向饱和烧碱溶液中投入一小块金属钠,充分反应后恢复到原来的温度,下列说法正确的是( )
| A. | 溶液中Na+浓度增大,有H2放出 | |
| B. | 溶液中Na+数目减少,有H2放出 | |
| C. | 溶液中Na+与OH-浓度都增大,有H2放出 | |
| D. | 溶液中OH-数目增大,有H2放出 |
12.下列物质中属于强电解质,但在给定条件下不能导电的是( )
| A. | 液态溴化氢 | B. | 蔗糖 | C. | 铝 | D. | 醋酸 |
2.10mL 0.1mol/L KI与10mL 0.05mol/L AgNO3溶液混合制得AgI溶胶,用下述电解质使该溶胶聚沉,聚沉能力最大的是( )
| A. | NaCl | B. | KNO3 | C. | MgSO4 | D. | AlCl3 |
1.下列物质不能由两种单质直接化合得到的是( )
| A. | SO2 | B. | FeCl2 | C. | MgO | D. | Na2O2 |
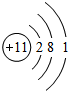 它的电子数为11,在化学反应中容易失去1 个电子成为Na+ (离子符号)
它的电子数为11,在化学反应中容易失去1 个电子成为Na+ (离子符号)