题目内容
2.10mL 0.1mol/L KI与10mL 0.05mol/L AgNO3溶液混合制得AgI溶胶,用下述电解质使该溶胶聚沉,聚沉能力最大的是( )| A. | NaCl | B. | KNO3 | C. | MgSO4 | D. | AlCl3 |
分析 10mL 0.1mol/L KI与10mL 0.05mol/L AgNO3溶液混合制得AgI溶胶,根据AgI胶粒带负电,所以所加电解质溶液中阳离子带电荷数越多,聚沉能力最大,据此分析.
解答 解:10mL 0.1mol/L KI与10mL 0.05mol/L AgNO3溶液混合制得AgI溶胶,因为AgI胶粒带负电,所以所加电解质溶液中阳离子带电荷数越多,聚沉能力最大,则DAlCl3中铝离子所带正电荷为+3最大,所以聚沉能力最大,
故选D.
点评 本题考查了胶体的聚沉能力大小判断,应注意加入电解质溶液使胶体聚沉能力最大的即带有与胶粒相反最大电荷的离子,难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
13.实验室配制500mL 0.1mol•L-1Na2CO3溶液时,不需要用到的仪器是( )
| A. |  托盘天平 | B. |  容量瓶 | C. |  胶头滴管 | D. |  分液漏斗 |
10.2A(g)?2B(g)+C(g)△H>0,达平衡时,要使v正降低、c(A)增大,应采取( )
| A. | 加压 | B. | 减压 | C. | 减小B的浓度 | D. | 降温 |
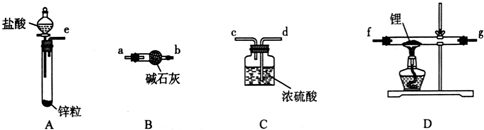
6.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
相关物质的部分物理性质如表格,实验流程如图1:

(1)制备苯甲酸乙酯,装置最合适的是图2中的B

反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(5)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(6)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水B.热水C.乙醇D.乙醇水混合溶液.
(一)制备苯甲酸乙酯
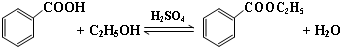
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

(1)制备苯甲酸乙酯,装置最合适的是图2中的B

反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(5)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(6)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水B.热水C.乙醇D.乙醇水混合溶液.
7.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一 段时间,以下叙述正确的是( )
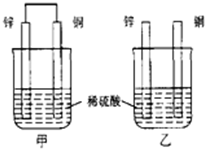

| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 甲中电子从锌片流出,经导线流入铜片 | |
| D. | 产生气泡的速度甲比乙慢 |
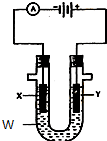 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: