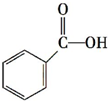
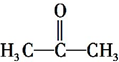
题目内容
11.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 9gD2O中含有的电子数为5NA | |
| B. | 4.5gSiO2晶体中含有的硅氧键的数目为0.15NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA |
分析 A.质量换算物质的量结合分子结构计算电子数;
B.根据1molSiO2晶体含有4mol的硅氧键计算;
C.甲烷中只存在C-H化学键,据此解答;
D.氯气与氢氧化钠发生歧化反应,氯从0价的单质氯变成-1价的NaCl中的氯,氯从0价的单质氯变成+1价的NaClO中的氯.
解答 解:A.9g D2O物质的量=$\frac{9g}{20g/mol}$=0.45mol,含有 电子数为0.45mol×10×NA=4.5NA,故A错误;
B.4.5gSiO2的物质的量为:$\frac{4.5g}{60g/mol}=\frac{3}{40}$mol,含有共用电子对的物质的量为:$\frac{3}{40}$mol×4=0.3mol,含有的硅氧键数目为0.3NA,故B错误;
C.甲烷中只存在C-H单键,故C正确;
D.氯气与氢氧化钠反应:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气完全反应,氯从0价的单质氯变成+1价的NaClO中的氯,失去1mol电子,氯从0价的单质氯变成-1价的NaCl中的氯,得到1mol电子,7.1gCl2为0.1mol,转移0.1NA电子,故D错误,故选C.
点评 本题主要考查的是阿伏伽德罗常数的应用,涉及电子数、化学键的计算,氧化还原反应等,难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
1.根据有机化合物的命名原则,下列命名正确的是( )
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 2-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
6.在常温下,将一定体积的某 NaOH 溶液分成两等分,与pH均为2的一元酸 HA、HB恰好中和,消耗两种酸溶液的体积分别为V1、V2(V1≠V2).则下列叙述中正确的是( )
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
16.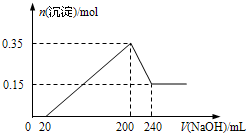 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )| A. | Mg和Al的总质量为8 g | |
| B. | 硫酸的物质的量浓度为5 mol/L | |
| C. | NaOH溶液的物质的量浓度为5 mol/L | |
| D. | 生成的H2在标准状况下的体积为11.2 L |
1.将5.1g镁铝合金溶于70mL 4mol/L硫酸中,当合金完全溶解后,再加入70mL 8mol/L的NaOH溶液,得沉淀的质量为13.6g,则加入硫酸时,产生H2的物质的量为( )
| A. | 0.2 mol | B. | 0.25 mol | C. | 0.3 mol | D. | 0.35 mol |
 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.
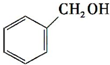 c.
c.