题目内容
下列离子方程式中正确的是( )
| A、NH4HSO4溶液中加入少量NaOH稀溶液:NH4++OH-→NH3?H2O |
| B、Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O→HClO+HSO3- |
| C、酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4-+7H2O2+6H+→2Mn2++6O2↑+10H2O |
| D、向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.加入少量NaOH稀溶液,只与氢离子反应;
B.发生氧化还原反应生成硫酸钙;
C.发生氧化还原反应,电子不守恒;
D.碳酸氢钙完全反应,生成碳酸钙、碳酸钠、水.
B.发生氧化还原反应生成硫酸钙;
C.发生氧化还原反应,电子不守恒;
D.碳酸氢钙完全反应,生成碳酸钙、碳酸钠、水.
解答:
解:A.NH4HSO4溶液中加入少量NaOH稀溶液的离子反应为H++OH-=H2O,故A错误;
B.Ca(ClO)2溶液中通入过量的二氧化硫气体的离子反应为2SO2+Ca2++2ClO-+2H2O=CaSO4↓+4H++2Cl-+SO42-,故B错误;
C.酸性高锰酸钾溶液中滴入少量过氧化氢的离子反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故C错误;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液的离子反应为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故D正确;
故选D.
B.Ca(ClO)2溶液中通入过量的二氧化硫气体的离子反应为2SO2+Ca2++2ClO-+2H2O=CaSO4↓+4H++2Cl-+SO42-,故B错误;
C.酸性高锰酸钾溶液中滴入少量过氧化氢的离子反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故C错误;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液的离子反应为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故D正确;
故选D.
点评:本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
下列叙述中不正确的是( )
| A、维生素C具有还原性,可作抗氧化剂 |
| B、油脂既能为人体提供热量,又能提供人体必需脂肪酸 |
| C、棉花、羊毛及合成纤维完全燃烧都只生成二氧化碳和水 |
| D、蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 |
如图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液.下列说法不正确的是( )
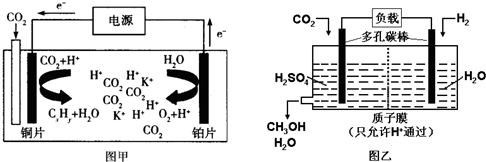

| A、甲中铜片作阴极,K+向铜片电极移动 |
| B、乙中正极发生的电极反应为CO2+6e-+6H+═CH3OH+H2O |
| C、甲中若CxHy为C2H4,则生成1mol C2H4的同时生成2mol O2 |
| D、乙中H2SO4的作用是增强溶液的导电性 |
把CoCl2溶解于浓盐酸中,溶液中存在下列平衡:
Co2++4Cl-?CoCl4-△H>0
粉红色 蓝色
有关上述可逆反应的下列说法不正确的是( )
Co2++4Cl-?CoCl4-△H>0
粉红色 蓝色
有关上述可逆反应的下列说法不正确的是( )
| A、对溶液所在体系加热,溶液蓝色加深 |
| B、对溶液所在体系用冰水降温,上述反应的平衡常数减小 |
| C、室温下,加水稀释,上述反应的平衡常数减小 |
| D、室温下,加水稀释至一定范围,溶液为粉红色 |
下列实验操作中,不正确的是( )
| A、称量固体药品时,药品不能直接放在托盘上 |
| B、实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 |
| C、过滤时,漏斗下端紧贴烧杯内壁 |
| D、称量物质时先取小砝码,再依次取较大的砝码 |
下列各组中的物质相互反应时,若两种试剂的量发生改变,不可用同一个离子方程式表示的是( )
| A、氯化铝和氨水 |
| B、硫酸钠和氢氧化钡 |
| C、碳酸氢钙和氢氧化钠 |
| D、碳酸氢钠溶液和盐酸 |
下列离子方程式中,正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| B、氧化铜与硫酸反应:O2-+2 H+═H2O |
| C、硫酸钠和氯化钡两种溶液混合:Ba2++SO42-═BaSO4↓ |
| D、盐酸与石灰石反应:CO32-+2H+═H2O+CO2↑ |