题目内容
如图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液.下列说法不正确的是( )
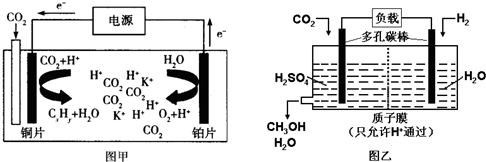

| A、甲中铜片作阴极,K+向铜片电极移动 |
| B、乙中正极发生的电极反应为CO2+6e-+6H+═CH3OH+H2O |
| C、甲中若CxHy为C2H4,则生成1mol C2H4的同时生成2mol O2 |
| D、乙中H2SO4的作用是增强溶液的导电性 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲图中:CO2电催化还原为碳氢化合物,由电子流向可知,则通入CO2的一极为电解池的阴极,另一极为阳极,阳极上氢氧根离子失电子生成氧气,乙图中,燃料电池的正极上氧气发生得电子的还原反应.
解答:
解:A.电解时,电子流向是:阳极→正极→负极→阴极,铜为阴极,所以阳离子K+向铜片电极移动,故A正确;
B.由图可知乙中正极上是二氧化碳发生得电子的还原反应的过程,发生的电极反应为CO2+6e-+6H+═CH3OH+H2O,故B正确;
C.若CxHy为C2H4,则电解的总反应为:2CO2+2H2O
3O2+C2H4,所以生成1 mol C2H4的同时生成3 molO2,故C错误;
D.乙中电解质溶液H2SO4的作用是增强导电性,故D正确;
故选C.
B.由图可知乙中正极上是二氧化碳发生得电子的还原反应的过程,发生的电极反应为CO2+6e-+6H+═CH3OH+H2O,故B正确;
C.若CxHy为C2H4,则电解的总反应为:2CO2+2H2O
| ||
D.乙中电解质溶液H2SO4的作用是增强导电性,故D正确;
故选C.
点评:本题考查学生电解池的工作原理知识,侧重于学生的分析能力的考查,注意两极反应式的书写以及氧化还原反应之间的关系,注意规律的总结是关键,难度不大.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
能说明NH4+的正四面体结构的是( )
| A、N-H键长相同 |
| B、N-H键能相同 |
| C、N-H键跟其它三个N-H键的键角相同 |
| D、N-H键的化学性质都相同 |
下列对于“摩尔”的理解正确的是( )
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、摩尔是物质的量的单位,简称摩,符号为mol |
| C、摩尔可以把物质的宏观质量与微观粒子的数量联系起来 |
| D、国际上规定,0.012 kg12C所含有的碳原子的物质的量为1 mol |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、78gNa2O2固体中含有的阴离子数为NA |
| B、标准状况下,2.24L氖气所含原子数为0.2NA |
| C、1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA |
| D、标准状况下,2.24L己烷含有分子的数目为0.1NA |
下列离子方程式中正确的是( )
| A、NH4HSO4溶液中加入少量NaOH稀溶液:NH4++OH-→NH3?H2O |
| B、Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O→HClO+HSO3- |
| C、酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4-+7H2O2+6H+→2Mn2++6O2↑+10H2O |
| D、向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
一定条件下,碳钢腐蚀与溶液pH的关系如下:
下列说法不正确的是( )
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
| A、在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓 |
| B、在pH>6溶液中,碳钢主要发生吸氧腐蚀 |
| C、在pH>7溶液中,碳钢腐蚀的正极反应为O2+4H++4e→2H2O |
| D、在pH<4溶液中,碳钢主要发生析氢腐蚀 |
对于胃溃疡较重的病人,不适合使用的抑酸剂是( )
| A、氢氧化镁 |
| B、氢氧化铝 |
| C、碳酸氢钠 |
| D、Na3C6H5O7﹒2H2O |
化学无处不在,运用化学知识判断下列与化学有关的说法正确的是( )
| A、地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油 |
| B、SO2能漂白纸浆等,故可广泛用于食品的漂白 |
| C、高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害 |
| D、为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
