题目内容
等物质的量的下列化合物与足量浓盐酸反应,得到氯气的物质的量最多的是 (填序号,下同),得到氯气的物质的量最少的是 .
已知:MnO4-+H++Cl-→Mn2++Cl2↑+H2O(未配平)
ClO3-+H++Cl-→Cl2↑+H2O(未配平)
ClO-+H++Cl-→Cl2↑+H2O(未配平)
A.KClO3 B.KMnO4 C.MnO2 D.Ca(ClO)2.
已知:MnO4-+H++Cl-→Mn2++Cl2↑+H2O(未配平)
ClO3-+H++Cl-→Cl2↑+H2O(未配平)
ClO-+H++Cl-→Cl2↑+H2O(未配平)
A.KClO3 B.KMnO4 C.MnO2 D.Ca(ClO)2.
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:根据氯气和氧化剂之间的反应方程式结合氧化剂的量和氯气的量之间的关系来回答.
解答:
解:根据得失电子配平方程式,根据氧化剂和氯气之间的关系式判断,MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O,1mol二氧化锰生成氯气1mol,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,1mol高锰酸钾可以生成氯气2.5mol,ClO3-+6H++5Cl-=3Cl2↑+3H2O,1mol氯酸钾可以生成氯气3mol,ClO-+2H++Cl-=Cl2↑+H2O,1mol次氯酸钙可以生成氯气2mol,根据方程式知,相同物质的量的氧化剂生成氯气最多的是氯酸钾,得到氯气的物质的量最少的是MnO2.
故答案为:A;C.
故答案为:A;C.
点评:本题考查了氧化还原反应,明确元素化合价是解本题关键,难度不大.

练习册系列答案
相关题目
下列物质中,能够导电的化合物是( )
| A、熔融氯化钠 |
| B、盐酸 |
| C、NaOH |
| D、CO2 |
下列有关热化学方程式的叙述中,正确的是( )
| A、含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(1)△H=+57.3kJ/mol | ||
| B、已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | ||
| C、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ | ||
D、已知C(s)+O2(g)=CO2(g)△H1;C(s)+
|
分类法在化学学科发展中起到了非常重要作用.下列分类标准合理的是( )
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据酸分子中含氢原子的个数将酸分为一元酸、二元酸、三元酸
③根据分散质粒子直径的大小将分散系分为溶液、胶体、浊液
④根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素.
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据酸分子中含氢原子的个数将酸分为一元酸、二元酸、三元酸
③根据分散质粒子直径的大小将分散系分为溶液、胶体、浊液
④根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素.
| A、③ | B、①③ | C、②③ | D、①②③④ |
下列离子方程式中正确的是( )
| A、NH4HSO4溶液中加入少量NaOH稀溶液:NH4++OH-→NH3?H2O |
| B、Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O→HClO+HSO3- |
| C、酸性高锰酸钾溶液中滴入少量过氧化氢:2MnO4-+7H2O2+6H+→2Mn2++6O2↑+10H2O |
| D、向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
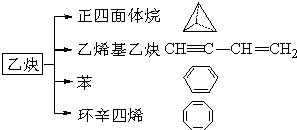 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: