题目内容
请按要求填空.
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 .
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3-→N2O3+H2O
②NH3+NO-→HNO2+H2O
③N2O4+H2O-→HNO3+HNO2
其中你认为一定不可能实现的是 .
(3)下列三个氧化还原反应中,氧化性最强的物质是 .
①2FeCl3+2KI═2FeCl2+2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还可应用上述反应中的 作氧化剂.
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3-→N2O3+H2O
②NH3+NO-→HNO2+H2O
③N2O4+H2O-→HNO3+HNO2
其中你认为一定不可能实现的是
(3)下列三个氧化还原反应中,氧化性最强的物质是
①2FeCl3+2KI═2FeCl2+2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还可应用上述反应中的
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)最高价态的元素只有氧化性,最低价态的元素只有还原性,中间价态的元素既有氧化性又有还原性;
(2)根据氧化还原反应的特征是元素化合价的升降判断;
(3)根据氧化剂的氧化性大于氧化产物的氧化性进行判断.
(2)根据氧化还原反应的特征是元素化合价的升降判断;
(3)根据氧化剂的氧化性大于氧化产物的氧化性进行判断.
解答:
解:(1)Fe3+、Mg2+、H+中的化合价都是最高价态,所以都只有氧化性;
S2-、I-中的化合价都是最低价态,所以都只有还原性;
Fe2+、S中的化合价是中间价态,所以既有氧化性又有还原性,
故答案为:Fe3+、Mg2+、H+; I-、S2-;Fe2+、S;
(2)氧化还原反应的特征是元素化合价的升降,②中N元素化合价只升高,不符合,故答案为:②;
(3)由①可知氧化性FeCl3>I2,②Cl2>FeCl3,③KMnO4>Cl2,则氧化性最强的为KMnO4,则若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还可应用上述反应中的FeCl3,
故答案为:KMnO4;FeCl3.
S2-、I-中的化合价都是最低价态,所以都只有还原性;
Fe2+、S中的化合价是中间价态,所以既有氧化性又有还原性,
故答案为:Fe3+、Mg2+、H+; I-、S2-;Fe2+、S;
(2)氧化还原反应的特征是元素化合价的升降,②中N元素化合价只升高,不符合,故答案为:②;
(3)由①可知氧化性FeCl3>I2,②Cl2>FeCl3,③KMnO4>Cl2,则氧化性最强的为KMnO4,则若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还可应用上述反应中的FeCl3,
故答案为:KMnO4;FeCl3.
点评:本题综合考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确元素化合价与氧化性和还原性的关系是解本题关键,难度不大.

练习册系列答案
相关题目
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )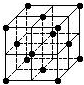

| A、C60属于离子晶体 |
| B、C60摩尔质量是720 |
| C、在C60晶胞中平均每个晶胞有14个C60分子 |
| D、每个C60分子周围与它距离最近等距离的C60分子有12个 |
关于物质的变化、性质及用途,下列叙述中正确的是( )
| A、化学变化中有化学键的断裂与生成,并伴有能量的变化,物理变化二者都不具备 |
| B、简单非金属阴离子只有还原性,而简单金属阳离子只有氧化性 |
| C、工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D、Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
下列叙述正确的是( )
| A、氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| B、含有最低价元素的化合物不一定具有很强的还原性 |
| C、阳离子只能得电子被还原,阴离子只能失电子被氧化 |
| D、在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
下列说法或表示方法中正确的是( )
| A、等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2 |
| B、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C、在25℃、101 kPa时,1克H2完全燃烧生成H2O放出热量142.9kJ.2H2O(1)=2H2(g)+O2(g)△H=-571.6kJ?mol-1 |
| D、稀的强酸和稀的强碱溶液反应的热化学方程式均为:H++OH-=H2O△H=-57.3kJ?mol-1 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温下,0.05 mol?L-1K2SO4溶液中含K+数目为0.1 NA |
| B、在标准状况下,1 mol O2与1 mol CCl4的体积相同 |
| C、常温常压下,14g由N2与CO组成的混合气体中含有的原子数目为 NA |
| D、8.7g MnO2与40mL 10 mol?L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA |