题目内容
15.完成下列问题:(1)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4 (密度为1.84g•mL-1,质量分数为98%)的体积为5.4mL.
(2)等温等压下,等体积的CO2和O3所含分子个数比为1:1,原子个数比为1:1,密度比为11:12.
(3)有12.4g Na2R含Na+ 为0.4mol,则Na2R的摩尔质量为 62g/mol,R的相对原子质量为 12.4g .
(4)在标准状况下1.7g氨气所占的体积为2.24L,它与同条件下0.15 mol H2S含有相同的氢原子数.
(5)100mL 0.5mol/L的(NH4)2SO4溶液中含有NH4+0.1mol,这些NH4+中所含有的电子数为6.02×1023.
分析 (1)依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释前后所含溶质的物质的量不变计算需要浓硫酸体积,据此解答;
(2)等温等压下,气体的体积之比等物质的量比等于分子数比;密度比为摩尔质量之比;
(3)有12.4g Na2R含Na+ 为0.4mol,根据M=$\frac{m}{n}$计算;
(4)根据n=$\frac{V}{{V}_{m}}$结合分子的构成计算;
(5)根据n=cV计算结合铵根离子含有的电子数解答.
解答 解:(1)密度为1.84g•mL-1,质量分数为98%的浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$=18mol/L,设需要浓硫酸体积为V,则依据溶液稀释前后所含溶质的物质的量不变得:V×18.4mol/L=1mol•L-1×100mL,解得:V=5.4mL;
故答案为:5.4;
(2)等温等压下,等体积的CO2和O3的物质的量相等,则所含分子个数比为1:1,根据分子式可知原子个数比为3:3=1:1,密度比为摩尔质量之比,即为44:48=11:12;
故答案为:1:1;1:1;11:12;
(3)有12.4g Na2R含Na+ 为0.4mol,则Na2R的物质的量是$\frac{0.4mol}{2}$=0.2mol,所以摩尔质量为$\frac{12.4g}{0.2mol}$=62g/mol,R的相对原子质量为62-2×23=16;
故答案为:62g/mol;16;
(4)在标准状况下1.7g氨气所占的体积为$\frac{1.7g}{17g/mol}$×22.4L/mol=2.24L,其中氢原子的物质的量是0.3mol,所以它与同条件下$\frac{0.3mol}{2}$=0.15mol H2S含有相同的氢原子数;
故答案为:2.24;0.15;
(5)100mL0.5mol/L的(NH4)2SO4溶液中含有NH4+的物质的量是0.1L×0.5mol/L×2=0.1mol,1个铵根离子含有10个电子,则这些NH4+中所含有的电子数为6.02×1023;
故答案为:0.1;6.02×1023.
点评 本题考查了有关物质的量的计算、物质的量浓度的计算,明确物质的量浓度与质量百分数浓度之间的换算、以及物质的量的有关计算,明确溶液稀释过程中物质的量不变是解题关键,题目难度不大.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| 化合物 | 密度/g•cm-3 | 沸点/℃ | 溶解性 |
| 正丁醇 | 0.810 | 118.0 | 可溶 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 微溶 |
| 乙醇 | 0.79 | 78.5 | 互溶 |
| 乙酸乙酯 | 0.88 | 77.06 | 可溶 |
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3~4滴浓硫酸.然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应.
(1)写出乙酸正丁酯制备的化学方程式:CH3COOH+CH3CH2CH2CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.本实验过程中可能产生多种有机副产物,写出其中一种的结构简式:CH2═CHCH2CH3或CH3CH2CH2CH2OCH2CH2CH2CH3.
(2)在乙酸乙酯的制备过程中采用了“边反应边蒸馏”的方式收集乙酸乙酯,乙酸正丁酯的制备过程中能否采用“边反应边蒸馏”的方式?为什么?不可以.因为乙酸正丁酯的沸点比乙酸和正丁醇都高
Ⅱ.乙酸正丁酯精产品的制备
(1)将乙酸正丁酯粗产品用如下操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用15%碳酸钠溶液洗涤,正确的操作步骤是C(填字母).
AA.①②③④B.③①④②
C.①④①③②D.④①③②③
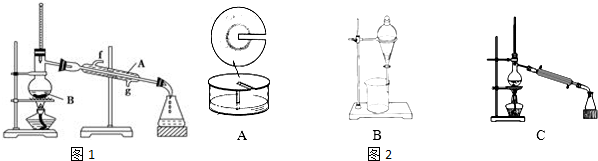
(2)将酯层采用如图1所示装置蒸馏.
①写出图1中仪器A的名称冷凝管,冷却水从g口进入(填字母).
②蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右.
Ⅲ.计算产率
(1)测量分水器内由乙酸与正丁醇反应生成水的体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率为79.4%.实验中为了提高乙酸正丁酯的产率,采取的措施是BC
A.使用催化剂 B.加过量乙酸 C.不断移去产物 D.缩短反应时间
(2)正丁醇若含有乙醇,有同学认为制得的乙酸丁酯中含有乙酸乙酯.为了证实该观点,可尝试选用下列C(填序号)装置来做实验,请简述与实验结论有关的实验过程和现象将制得的乙酸丁酯进行蒸馏,看能否得到78℃左右的馏分,且该馏分不溶于饱和碳酸钠溶液.
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 用食醋可除去热水壶内壁的水垢 | |
| C. | 烹鱼时加适量醋和酒可以增加香味 | |
| D. | 医用酒精消毒是利用其氧化性使蛋白质变性 |
| A. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| B. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| C. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| D. | 分液时,分液漏斗的顶塞应打开或使塞上凹槽与壁上小孔对准 |
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 物质的摩尔质量等于该物质的相对分子质量 | |
| C. | O22-离子的摩尔质量是32 g•mol-1 | |
| D. | 1 mol H2O的质量为18 g•mol- |
 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.【提出问题】小松想探究分子的运动速率与相对分子质量的关系.
【假设猜想】①分子质量(相对分子质量)越大,分子运动速率越快;②分子质量(相对分子质量)越小,分子运动速率越快.
【查阅资料】已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体).
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】
(1)氨分子的相对分子质量小于(填“大于”、“等于”或“小于”)氯化氢分子的相对分子质量,由此可知,相对分子质量越小(填“大”或“小”),分子的速率越快(填“快”或“慢”).
(2)反应的化学方程式为NH3+HCl═NH4Cl.
【拓展探究】小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红分别滴入到等量的热水和冷水中,其实验现象如下所示.
| 实验过程 | 冷水 | 热水 |
| 开始 | 红色扩散较慢 | 红色扩散较快 |
| 长久放置 | 最终均成为红色、均匀、透明的液体 | |
| A. | 该溶液中 c(H2CO3)>c(CO32-) | |
| B. | 常温下,该溶液的pH>7 | |
| C. | 该溶液中阳离子总数小于阴离子总数 | |
| D. | 常温下,加水稀释时$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$不变 |
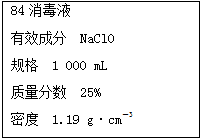 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
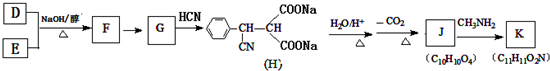
 ,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.
,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.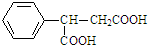 +CH3NH2$\stackrel{一定条件下}{→}$
+CH3NH2$\stackrel{一定条件下}{→}$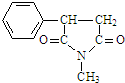 +2H2O.
+2H2O.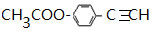 .
.