题目内容
16.下列说法正确的是( )| A. | 用3mL稀硫酸溶液与足量Zn反应,当气泡稀少时加入5mL浓硫酸,又迅速产生较多气泡,由上述操作及现象得出结论:硫酸浓度增大,产生H2的反应速率加快 | |
| B. | FeCl3+3KSCN?Fe(SCN)3(血红色)+3KCl,向溶液中加入KCl固体可快速看到血红色 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是放热反应 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
分析 A.浓硫酸与锌反应不生成氢气;
B.加入氯化钾,不参加反应;
C.Ba(OH)2•8H2O与NH4Cl的反应是吸热反应;
D.化学能可转化为热能.
解答 解:A.如为98%的浓硫酸与锌反应,则不生成氢气,故A错误;
B.化学平衡为Fe3++3SCN-=Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,平衡不动,故B错误;
C.Ba(OH)2•8H2O与NH4Cl的反应是吸热反应,故C错误;
D.化学反应中的能量变化通常表现为热量的变化,有时以热能、光能、电能等形式转化,故D正确.
故选D.
点评 本题考查较为综合,涉及化学反应与能量变化,化学平衡的移动以及反应速率的影响,为高考常见题型,注意把握相关基础知识学习,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:
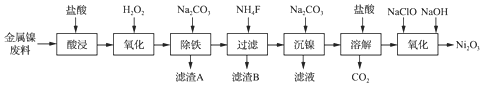
流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等)等.
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.

流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.
20.表是元素周期表的一部分,针对表中的①-⑧八种元素,用元素符号或化学式回答相关问题:
(l)在这些元素中,化学性质最不活泼原子的原子结构示意图为 .
.
(2)用电子式表示①与③形成化合物的过程 .
.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①②③④四种元素的简单离子半径由大到小的顺序是F->Na+>Mg2+>Al3+.(用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是Br2>Cl2>F2.(用化学式和“>”表示).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | |||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 四 | ⑦ | ⑧ |
 .
.(2)用电子式表示①与③形成化合物的过程
 .
.(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①②③④四种元素的简单离子半径由大到小的顺序是F->Na+>Mg2+>Al3+.(用离子符号和“>”表示).
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是Br2>Cl2>F2.(用化学式和“>”表示).
11.NA代表阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 常温常压下,2.24 L SO2与O2混合气体中所含氧原子数小于0.2NA | |
| B. | 点解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| C. | 常温下,1 L pH=13的Ba(OH)2中含有的OH-数目为0.2NA | |
| D. | 10 mL 98%的H2SO4溶液,加入水中稀释至100 mL,H2SO4的质量分数为9.8% |
8.FeS2与HNO3反应后的氧化产物为Fe(NO3)3和H2SO4,若反应中FeS2与HNO3的物质的量之比为1:8,则HNO3的还原产物为( )
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
6.某透明溶液中,能大量共存的离子组是( )
| A. | Na+、Cu2+、Clˉ、SO42- | B. | Ca2+、K+、CO32ˉ、NO3ˉ | ||
| C. | Na+、H+、Clˉ、CO32ˉ | D. | K+、H+、Fe2+、NO3ˉ |