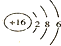题目内容
4.两元素可以形成AB型离子化合物,它们的原子序数可能是( )| A. | 1和17 | B. | 12和9 | C. | 11和16 | D. | 12和8 |
分析 两元素可以形成AB型离子化合物,说明中A、B元素化合价的绝对值相等,如ⅠA族与ⅤⅡA族元素,或ⅡA族与ⅥA族元素,据此对各选项进行判断.
解答 解:A.1和17,1号元素是H元素、17号元素是Cl元素,二者能形成HCl,HCl不属于离子化合物,故A错误;
B.12号元素是Mg元素、9号元素是F元素,二者形成的混合物为MgF2,不满足条件,故B错误;
C.11号元素为Na,16号元素是S元素,二者形成的混合物为Na2S,不满足条件,故B错误;
D.12号元素是Mg元素、8号元素是O元素,二者能形成离子化合物MgO,故D正确;
故选D.
点评 本题考查了原子结构与元素性质,题目难度不大,明确常见元素的原子结构与性质的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
15. 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
(1)N2H4、H2O2的组成元素中第一电离能最大的元素是N(填元素符号),1molN2H4分子中所含σ键的数目为5NA.
(2)基态钛原子的核外电子排布式为1s22s22p63s23p63d24s2,其未成对电子数为2.
(3)H2O2受热易分解为H2O,H2O的空间构型为V形,其中心原子的杂化轨道类型为sp3杂化,H2S和H2O2的主要物理性质如下表,造成二者物理性质差异的主要原因是H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,H2O2在水中的溶解度大于H2S的.
(4)氧化镁与氮化硼均可用作航天器返回舱的热屏蔽材料,晶格能:氧化镁大于(填“大于”或“小于”)氧化钙,其原因是镁离子半径小于钙离子半径.
(5)立方氮化硼的晶胞如图所示,则处于晶胞顶点的原子的配位数为4,若晶胞边长为acm,则立方氮化硼的密度是$\frac{100}{{a}^{3}{N}_{A}}$g•cm-3(设NA为阿伏伽德罗常数的数值).
 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:(1)N2H4、H2O2的组成元素中第一电离能最大的元素是N(填元素符号),1molN2H4分子中所含σ键的数目为5NA.
(2)基态钛原子的核外电子排布式为1s22s22p63s23p63d24s2,其未成对电子数为2.
(3)H2O2受热易分解为H2O,H2O的空间构型为V形,其中心原子的杂化轨道类型为sp3杂化,H2S和H2O2的主要物理性质如下表,造成二者物理性质差异的主要原因是H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,H2O2在水中的溶解度大于H2S的.
| 熔点/K | 沸点/K | 水中溶解度(标准状况下) | |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
(5)立方氮化硼的晶胞如图所示,则处于晶胞顶点的原子的配位数为4,若晶胞边长为acm,则立方氮化硼的密度是$\frac{100}{{a}^{3}{N}_{A}}$g•cm-3(设NA为阿伏伽德罗常数的数值).
12.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 空气中:SO2、NO、N2、CO2 | |
| B. | 0.1mol•L-1的NaNO3溶液中:K+、I-、Cl-、SO42- | |
| C. | 与铝反应生成大量氢气的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- |
16.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
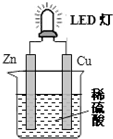

| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,导线中不会有电子流动 | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
13.下列物质的制备,符合工业生产实际的是( )
| A. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 | |
| B. | 工业上用接触法制硫酸,在接触室里制出硫酸 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上主要从海水中提取碘 |
14.下列事实不能用平衡移动原理解释的是( )
| A. | 钢铁在潮湿的空气中比在干燥空气中更容易生锈 | |
| B. | 用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 | |
| C. | 蒸馏水和0.1 mol•L-1NaOH溶液中的c(H+),前者大于后者 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g),工业上合成氨常在高压下进行 |
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题: