题目内容
 某实验过程如图所示,则图③试管中的现象是( )
某实验过程如图所示,则图③试管中的现象是( )| A、铜片溶解,产生无色气体,该气体遇空气变为红棕色 |
| B、铜片溶解,产生无色气体,该气体遇到空气不变色 |
| C、铜片溶解,放出红棕色有刺激性气味的气体 |
| D、无明显现象,因稀硫酸不与铜反应 |
考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:试管①中铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据图知,Cu有剩余,硝酸不足量,向③中加入稀硫酸,酸性条件下,硝酸根离子具有强氧化性,相当于又有稀硝酸,则硝酸和铜又发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
解答:
解:管①中铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据图知,Cu有剩余,硝酸不足量,向③中加入稀硫酸,酸性条件下,硝酸根离子具有强氧化性,相当于又有稀硝酸,则硝酸和铜又发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的无色气体NO不稳定,被氧气氧化生成红棕色气体NO2,同时Cu片溶解
所以看到的现象是铜片溶解,且有无色气体生成,该气体在试管口变为红棕色,故选A.
所以看到的现象是铜片溶解,且有无色气体生成,该气体在试管口变为红棕色,故选A.
点评:本题考查了硝酸和铜的反应,明确“酸性条件下,硝酸根离子具有强氧化性”是解本题关键,向含有硝酸根离子的溶液中加入稀硫酸,相当于溶液中含有硝酸,为易错题.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
下列实验装置正确的是( )
A、 收集SO2气体 |
B、 制取并收集O2 |
C、 检验溴乙烷与NaOH醇溶液共热产生的C2H4 |
D、 从食盐水中提取NaCl |
不能通过单质直接化合得到的是( )
| A、CuS |
| B、FeS |
| C、PCl3 |
| D、SiO2 |
下列说法正确的是( )
| A、向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,由此证明了NaHCO3溶解度比Na2CO3小 | ||
| B、C(s,石墨)=C(s,金刚石) 该反应吸热熵减,常压下,升温或者降温均为非自发反应 | ||
| C、在铁制品表面镀锌或者镀锡,都是采用外加保护层的方法来防止铁的腐蚀 | ||
D、向0.1mol/L CH3COOH溶液中加入少量的冰醋酸,溶液中
|
下列说法正确的是( )
| A、用福尔马林对种子消毒不属于蛋白质变性 |
B、实验证实化合物  可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 |
| C、能用新制的氢氧化铜鉴别乙醛与蔗糖溶液 |
D、化合物 的分子式为C13H8O4N2 的分子式为C13H8O4N2 |
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.
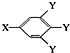 (其中:-X、-Y均为官能团).据此回答下列问题:
(其中:-X、-Y均为官能团).据此回答下列问题: