题目内容
1.填表:| 原子序数 | 核外电子排布式 | 外围电子排布式 | 周期表中的位置 |
| 16 | 1S22S22P63S23P4 | 3s23p4 | 第三周期第ⅥA族 |
| 23 | 1S22S22P63S23P63d34s2 | 3d34s2 | 第四周期第ⅤB族 |
| 34 | 1S22S22P63S23P63d104s24p4 | 4s24p4 | 第四周期第ⅥA族 |
分析 原子序数与核外电子数相等,根据构造原理写出基态该原子核外电子排布式;
外围电子排布式:是指将过渡元素原子的电子排布式中符合稀有气体的原子的电子排布的部分(原子实)或主族、0族元素的内层电子排布省略后剩下的式子;
周期表中的位置:电子层数等于周期序数,族序数看价电子,如果d轨道没有价电子就是主族元素,有几个价电子就是第几主族,
如果d轨道上有价电子就是副族元素,价电子有几个就是第几副族,比如23号元素的价电子为3d34s2,那么就是第ⅤB,如果价电子为8、9或者10个就都是第Ⅷ族,价电子d轨道上是10个电子,s轨道上有几个电子就是第几副族,比如3d104s1就是第ⅠB族,由此分析解答.
解答 解:原子序数为16,核外电子数为16,根据能量最低原理可写出电子排布式为1S22S22P63S23P4,外围电子排布式为:3s23p4,位于第三周期第ⅥA族,
原子序数为23,核外电子数为23,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d34s2,外围电子排布式为:3d34s2,位于第四周期第ⅤB族,
原子序数为34,核外电子数为34,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d104s24p4,外围电子排布式为:4s24p4,位于第四周期第ⅥA族,
故答案为:
| 原子序数 | 核外电子排布式 | 外围电子排布式 | 周期表中的位置 |
| 16 | 1S22S22P63S23P4 | 3s23p4 | 第三周期第ⅥA族 |
| 23 | 1S22S22P63S23P63d34s2 | 3d34s2 | 第四周期第ⅤB族 |
| 34 | 1S22S22P63S23P63d104s24p4 | 4s24p4 | 第四周期第ⅥA族 |
点评 本题考查原子核外电子排布和周期表的位置知识点,为高频考点,利用构造原理写出基态该原子核外电子排布式是解题关键,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
12.把下列各组物质同时加入水中,只得到无色透明溶液的是( )
| A. | K2SO4 HCl BaCl2 | B. | Na2CO3 K2SO4 KCl | ||
| C. | FeCl3 NaCl KOH | D. | CuSO4 HCl NaNO3 |
16.在石墨晶体中,每一层有无数个正六边形构成,同一层内每个碳原子与相邻的三个碳原子以C-C键相结合.则石墨晶体中碳原子数与C-C键之比为( )
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
10.用一种试剂就能将下列五种有机物区分开来,①乙酸;②乙醛;③苯;④苯酚;⑤四氯化碳;这种试剂可以是( )
| A. | . 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | 氯化铁溶液 |
11.某原电池总反应的离子方程式是:Zn+Cu2+═Zn2++Cu,依据此反应设计原电池的正确组合是( )
| 选项 | 正极 | 负极 | 电解质溶液 |
| A | Cu | Zn | 稀盐酸 |
| B | C | Zn | 硫酸铜溶液 |
| C | Cu | Zn | 氯化铜溶液 |
| D | Cu | Zn | 硝酸铜溶液 |
| A. | A | B. | B | C. | C | D. | D |
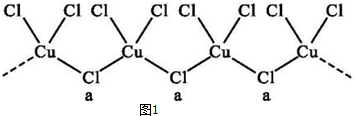
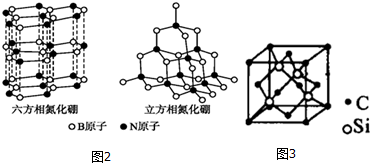
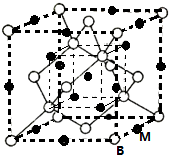 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):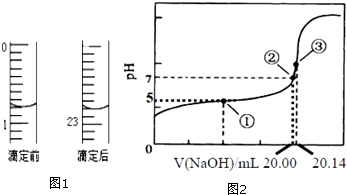 醋酸是日常生活中常见的弱酸.
醋酸是日常生活中常见的弱酸.