题目内容
 25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示.下列说法正确的是( )
25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示.下列说法正确的是( )| A、Ksp(CuS)约为l×10-20 |
| B、向Cu2+浓度为10-5mol?L-1废水中加入ZnS粉末,会有CuS沉淀析出 |
| C、向l00mL浓度均为10-5mol?L-1 Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol?L-1 Na2S溶液,Zn2+先沉淀 |
| D、Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A、CuS饱和溶液中存在沉淀溶解平衡:CuS(s)?Cu2+(aq)+S2-(aq),据此书写计算即可;
B、计算此时的Qc与Ksp比较即可;
C、依据溶度积常数判断,越难溶的物质,Ksp越小,越容易沉淀;
D、依据物料守恒判断即可.
B、计算此时的Qc与Ksp比较即可;
C、依据溶度积常数判断,越难溶的物质,Ksp越小,越容易沉淀;
D、依据物料守恒判断即可.
解答:
解:A、在25℃时,CuS饱和溶液中存在沉淀溶解平衡:CuS(s)?Cu2+(aq)+S2-(aq),Ksp(CuS)=c(Cu2+)×c(S2-)=10-25×10-10=10-35,故A错误;
B、由于在25℃下,CuS溶液的是Ksp是10-35,故向Cu2+浓度为10-5mol?L-1废水中加入ZnS粉末,会有CuS沉淀析出,故B正确;
C、依据此图可知,CuS的Ksp最小,故CuS最难溶,那么首先出现的沉淀是CuS,故C错误;
D、Na2S溶液中:S元素的存在形式为:S2-、HS-、H2S、且存在Na元素的物质的量为S元素物质的量的2倍,故D正确,故选BD.
B、由于在25℃下,CuS溶液的是Ksp是10-35,故向Cu2+浓度为10-5mol?L-1废水中加入ZnS粉末,会有CuS沉淀析出,故B正确;
C、依据此图可知,CuS的Ksp最小,故CuS最难溶,那么首先出现的沉淀是CuS,故C错误;
D、Na2S溶液中:S元素的存在形式为:S2-、HS-、H2S、且存在Na元素的物质的量为S元素物质的量的2倍,故D正确,故选BD.
点评:本题主要考查了沉淀溶解平衡曲线,侧重于学生的分析能力的考查,注意掌握图线中lgc(M2+)、lgc(S2-)数值越大,实际浓度越小是解题的关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )


| A、若X为SO3、SO2和O2的混合物,则生成1 mol Cu2O需转移2 mol电子 |
| B、相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C、途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3 |
| D、Y一定是葡萄糖 |
下列物质中,能溶于水形成强酸的是( )
| A、CO2 |
| B、SiO2 |
| C、SO3 |
| D、Fe2O3 |
 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )| A、b极为电池的负极 |
| B、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生12NAq库仑的电量 |
| C、电池工作时电流由a极沿导线经灯泡再到b极 |
| D、电池正极的电极反应为:O2+4e-+2H2O=4OH- |
 乙烯酮(CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到.也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到.
乙烯酮(CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到.也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到.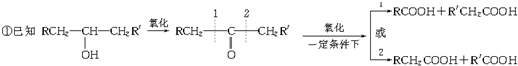

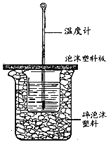 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题: