题目内容
17.如表为元素周期表的一部分.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)①的元素名称是锂,其在周期表中的位置是第2周期ⅠA族.
(2)②③④的原子半径由大到小的顺序是C>N>O(用元素符号表示).
(3)⑦⑧的最高价含氧酸的酸性由强到弱的顺序是H3PO4>H2SiO3(用化学式表示).
(4)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式是Al2O3+2OH-=2AlO2-+H2O.
分析 由元素在周期表中的位置可知,①为Li、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为P,
(1)Li的名称为锂;
(2)同周期从左向右原子半径减小;
(3)非金属性越强,最高价含氧酸的酸性越强;
(4)氧化铝与NaOH反应生成偏铝酸钠和水.
解答 解:由元素在周期表中的位置可知,①为Li、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为P,
(1)Li的名称为锂,位于第2周期ⅠA族,故答案为:锂;第2周期ⅠA族;
(2)同周期从左向右原子半径减小,则②③④的原子半径由大到小的顺序是C>N>O,故答案为:C>N>O;
(3)非金属性P>Si,⑦⑧的最高价含氧酸的酸性由强到弱的顺序是H3PO4>H2SiO3,故答案为:H3PO4>H2SiO3;
(4)氧化铝与NaOH反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
7.在实验室里进行分液操作时,下列实验仪器一定用不到的是( )
| A. | 烧杯 | B. | 分液漏斗 | C. | 铁架台 | D. | 酒精灯 |
8.氟(F)是卤素中核电荷数最小的元素,下列有关氟的说法错误的是( )
| A. | 氟的原子半径比氯的原子半径小 | B. | 氟化氢比氯化氢稳定 | ||
| C. | 氟的最高价是+7价 | D. | 氟气的氧化性比氯气的强 |
12.下列模型表示四种分子,分子中所有原子处于同一平面的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列物质中,属于电解质的是( )
| A. | 铜片 | B. | 硫酸溶液 | C. | 氯化钠 | D. | 酒精 |
9.下列化学用语书写正确的是( )
| A. | 用电子式表示氢溴酸的形成过程为: | |
| B. | 乙烯的结构简式:C2H4 | |
| C. | 四氯化碳的电子式为: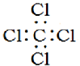 | |
| D. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co |
6.X,Y,Z,M,W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y,Z,M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见的大气污染气体甲.X,Y,Z三种元素形成化合物乙.下列说法错误的是( )
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | W元素的晶体单质是一种良好的半导体材料 | |
| C. | X分别与Y,Z,M,W形成的常见化合物中,稳定性最好的是XM | |
| D. | 化合物乙中一定只有共价键 |
7.下列图中的实验方案,能达到实验目的是( )
| A. | 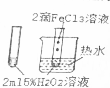 验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 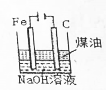 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  验证盐酸、碳酸、苯酚酸性的强弱 | |
| D. |  制取乙酸乙酯 |