题目内容
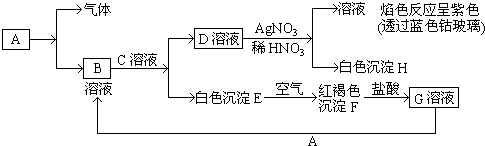
A、B是两种含氧酸的酸式盐溶液,焰色反应均显黄色,D、E均为无色气体,H为不溶于酸的白色沉淀.回答以下问题:

(1)化学式:A B
(2)B溶液与某强碱反应恰好使沉淀后溶液显中性时离子反应方程式:
(3)A与B溶液混合时发生反应的离子反应方程式: .

(1)化学式:A
(2)B溶液与某强碱反应恰好使沉淀后溶液显中性时离子反应方程式:
(3)A与B溶液混合时发生反应的离子反应方程式:
考点:无机物的推断
专题:
分析:A、B是两种含氧酸的酸式盐溶液,焰色反应均显黄色,均含有Na+离子,二者反应得到C溶液与无色气体D,电解C溶液阳极生成无色气体E,则E为O2,气体D与氧气反应生成F,F溶于水得到G,而G与氯化物反应得到白色沉淀H,考虑H为BaSO4,则D为SO2,F为SO3,G为H2SO4,B的溶液与某种强碱反应也得到H,应是NaHSO4与氢氧化钡反应,则B为NaHSO4,故A为NaHSO3,据此解答.
解答:
解:A、B是两种含氧酸的酸式盐溶液,焰色反应均显黄色,均含有Na+离子,二者反应得到C溶液与无色气体D,电解C溶液阳极生成无色气体E,则E为O2,气体D与氧气反应生成F,F溶于水得到G,而G与氯化物反应得到白色沉淀H,考虑H为BaSO4,则D为SO2,F为SO3,G为H2SO4,B的溶液与某种强碱反应也得到H,应是NaHSO4与氢氧化钡反应,则B为NaHSO4,故A为NaHSO3,
(1)由上述分析可知,A为NaHSO3,B为,故答案为:NaHSO3;NaHSO4;
(2)NaHSO4与氢氧化钡反应恰好使沉淀后溶液显中性时离子反应方程式:SO42-+2H++Ba2++2 OH-═BaSO4↓+2 H2O,故答案为:SO42-+2H++Ba2++2 OH-═BaSO4↓+2 H2O;
(3)A与B溶液混合时发生反应的离子反应方程式为:HSO3-+H+═SO2↑+H2O,故答案为:HSO3-+H+═SO2↑+H2O.
(1)由上述分析可知,A为NaHSO3,B为,故答案为:NaHSO3;NaHSO4;
(2)NaHSO4与氢氧化钡反应恰好使沉淀后溶液显中性时离子反应方程式:SO42-+2H++Ba2++2 OH-═BaSO4↓+2 H2O,故答案为:SO42-+2H++Ba2++2 OH-═BaSO4↓+2 H2O;
(3)A与B溶液混合时发生反应的离子反应方程式为:HSO3-+H+═SO2↑+H2O,故答案为:HSO3-+H+═SO2↑+H2O.
点评:本题考查无机物推断,电解C溶液阳极生成无色气体、物质的颜色、颜色反应为突破口,再结合酸根得到气体与氧气反应,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列分子中,所有原子的最外层均为8电子结构的是( )
| A、BeCl2 |
| B、H2S |
| C、NCl3 |
| D、SF6 |