题目内容
5.在下列反应中,HNO3既表现出氧化性,又表现出酸性的是( )| A. | H2S+2HNO3═S↓+2NO2↑十2H2O | B. | CuO+2HNO3═Cu (NO3)2十H2O | ||
| C. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑十O2↑十2H2O | D. | 3Cu+8HNO3═3Cu (NO3) 2+2NO↑十4H2O |
分析 反应中,HNO3既表现出氧化性,又表现出酸性,则N元素的化合价降低,且生成硝酸盐,以此来解答.
解答 解:A.N元素的化合价全部降低,则只体现硝酸的氧化性,故A不选;
B.反应中N元素的化合价不变,只生成硝酸盐,则只体现酸性,故B不选;
C.N元素的化合价全部降低,O元素的化合价升高,该反应中体现硝酸的氧化性和还原性,故C不选;
D.N元素的化合价降低,且生成硝酸盐,则HNO3既表现出氧化性,又表现出酸性,故D选;
故选D.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中氧化剂的考查,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
13.下列说法正确的是??( )
| A. | 苯的结构简式为 有三个双键,可与3 mol H2发生加成反应 有三个双键,可与3 mol H2发生加成反应 | |
| B. | 只用水就可以鉴别四氯化碳、苯和乙醇 | |
| C. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| D. | 将1 mL苯和1 mL水充分混合后静置,二者互溶 |
20.现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位素可测定文物年代,表示这种同位素原子组成的符号是614C,元素Z的离子结构示意图为 ,元素Y在周期表中的位置是第二周期VA族.
,元素Y在周期表中的位置是第二周期VA族.
(2)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子.
(3)元素X与元素Y相比,非金属性较强的是N (用元素符号表示),下列表述能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 ,元素Y在周期表中的位置是第二周期VA族.
,元素Y在周期表中的位置是第二周期VA族.(2)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子.
(3)元素X与元素Y相比,非金属性较强的是N (用元素符号表示),下列表述能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
10.下列给出的各组物质,不能完成下列转化的是( )


| 物质 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| A | C6H12O6 | CH3CH2OH | CH3CHO | CH3COOH | CO2 |
| B | NH4Cl | NH3 | N2 | NO2 | HCl |
| C | NaCl | Na | Na2O | Na2O2 | Cl2 |
| D | CH4 | C | CO | CO2 | H2 |
| A. | A | B. | B | C. | C | D. | D |
3.以下有关食品化学知识的叙述不正确的是( )
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 新鲜蔬菜做熟后,所含维生素C会有损失 | |
| C. | 纤维素在人体内可水解为葡萄糖 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
4. 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
(1)p为正极,A极发生了氧化(填反应类型)反应.
(2)D为阴极,试管里收集到H2.
(3)C极的电极方程式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得C、D两极上产生的气体的实验数据如下:
仔细分析上表,请说出得到以上实验数据可能的原因是开始时阴、阳两极气体体积比为3:1,10分钟时约为2:1,说明开始时氧气溶解于溶液中.
(5)当电路中通过0.004mol电子时,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为64g•mol-1.
(6)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”、“减小”或“不变”).
 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:(1)p为正极,A极发生了氧化(填反应类型)反应.
(2)D为阴极,试管里收集到H2.
(3)C极的电极方程式是4OH--4e-=O2↑+2H2O.
(4)在电解过程中,测得C、D两极上产生的气体的实验数据如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成 气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成 气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(5)当电路中通过0.004mol电子时,B电极上沉积金属X的质量为0.128g,则此金属的摩尔质量为64g•mol-1.
(6)当反应进行一段时间后,A、B电极附近溶液的pH不变(填“增大”、“减小”或“不变”).
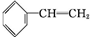 +Br2
+Br2
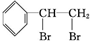 .
. $\stackrel{稀、冷KMnO_{4}/OH-}{→}$
$\stackrel{稀、冷KMnO_{4}/OH-}{→}$ .请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应生成物的结构简式 ;
; ;
;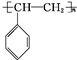 .
. )③乙烯④葡萄糖⑤乙醇
)③乙烯④葡萄糖⑤乙醇