题目内容
10.实验室配置100mL 1.0mol/L Na2CO3溶液,下列有关叙述正确的是( )| A. | 用托盘天平称取28.6g Na2CO3•10H2O晶体 | |
| B. | 将Na2CO3固体放入容器瓶中,加水至刻度线 | |
| C. | 定容时俯视液面,所得溶液浓度偏低 | |
| D. | 加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 |
分析 依据m=CVM计算需要溶质的质量;分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$进行分析,凡是使n偏大,或者使V偏小的操作,都会使溶液浓度偏高,反之,溶液浓度偏低.
解答 解:A.配置100mL 1.0mol/L Na2CO3溶液,需要Na2CO3•10H2O晶体质量m=1.0mol/L×0.1L×286g/mol=28.6g,故A正确;
B.容量瓶为精密仪器,不能用来溶解固体,故B错误;
C.定容时俯视液面,导致溶液体积偏小,溶液浓度偏高,故C错误;
D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体,导致溶质的物质的量偏小,溶液浓度偏低,故D错误;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确有关物质的量浓度计算公式及误差分析方法是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.能用元素周期律解释的是( )
| A. | 酸性:H2SO3>H2CO3 | B. | 熔沸点:HF>HCl | ||
| C. | 碱性:NaOH>Al(OH)3 | D. | 热稳定性:Na2CO3>CaCO3 |
18.如图是用稀HNO3和Cu制取少量NO并验证氮氧化合物性质的装置.下列说法错误的是( )
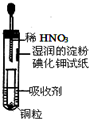

| A. | 吸收剂可以是NaOH溶液 | B. | 试管上部的气体始终为无色 | ||
| C. | 小试管中溶液最终呈蓝色 | D. | 试纸先变红后褪色 |
15.二氧化氯是国际上公认的含氯消毒剂中位移的高效消毒灭菌剂,对一切经水体传播的病原微生物均有很好的杀灭效果,在水处理等方面应用广泛.二氧化氯的部分性质如表.某小组拟用如图A所示装置模拟工业发用潮湿的KCIO3和草酸(H2C2O2)在60℃时反应制取收集液态ClO2
回答下列问题:
(1)仪器A的名称是圆底烧瓶
(2)温度计的作用是测量反应温度,使用电动搅拌泵搅拌反应混合物的目的是增大反应速率
(3)保存液态ClO2的条件是d(填字母)
a.常温、密封、不避光 b.低温、敞口、不避光 c.常温、敞口、避光 d.低温、密封、避光
(4)烧碱溶液的作用是吸收尾气
(5)亚氯酸钠(NaClO2)也可用于二氧化氯的制备
①观察亚氯酸钠的溶解度曲线图B,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是减压蒸发,温度略高于(或大于)38℃
②设计实验方案,验证酸性条件下亚氯酸钠的氧化性强于碘(I2)在淀粉碘化钾溶液中加入少量NaClO2溶液,并加入少量的稀硫酸,溶液变蓝说明亚氯酸钠的氧化性强于碘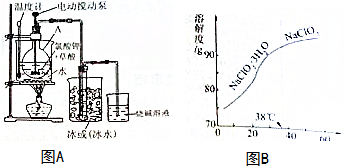
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
(1)仪器A的名称是圆底烧瓶
(2)温度计的作用是测量反应温度,使用电动搅拌泵搅拌反应混合物的目的是增大反应速率
(3)保存液态ClO2的条件是d(填字母)
a.常温、密封、不避光 b.低温、敞口、不避光 c.常温、敞口、避光 d.低温、密封、避光
(4)烧碱溶液的作用是吸收尾气
(5)亚氯酸钠(NaClO2)也可用于二氧化氯的制备
①观察亚氯酸钠的溶解度曲线图B,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是减压蒸发,温度略高于(或大于)38℃
②设计实验方案,验证酸性条件下亚氯酸钠的氧化性强于碘(I2)在淀粉碘化钾溶液中加入少量NaClO2溶液,并加入少量的稀硫酸,溶液变蓝说明亚氯酸钠的氧化性强于碘

12.下列物质互为同位素的是( )
| A. | O2与O3 | B. | CH≡CH与CH2=CH2 | ||
| C. | ${\;}_{8}^{16}$O与${\;}_{8}^{18}$O | D. | CH3-CH2-CH2-CH3与CH3-CH2-CH3 |