题目内容
5.0.1mol/L的NaHCO3溶液中(1)按物质的量浓度由大到小顺序排列该溶液中各种离子浓度c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(2)c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2c(CO32-).
(3)c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3).
分析 (1)碳酸氢根离子的水解程度大于其电离程度,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(HCO3-),据此判断碳酸氢钠溶液中的离子浓度大小;
(2)根据碳酸氢钠溶液中的电荷守恒分析;
(3)根据碳酸氢钠溶液中的物料守恒解答.
解答 解:(1)碳酸氢钠溶液中,碳酸氢根离子的水解程度大于其电离程度,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)根据碳酸氢钠溶液中的电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),
故答案为:c(HCO3-)+c(OH-)+2c(CO32-);
(3)根据碳酸氢钠溶液的物料守恒可得:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),
故答案为:c(HCO3-)+c(CO32-)+c(H2CO3).
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 某温度时,KW=10-12,此温度下PH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明HSO3-在水溶液中只存在电离 | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 稀释 0.1mol/L CH3COONa溶液过程中,c(OH-)/c(CH3COO-)增大 |
16.现有某氯化物与氯化镁的混合物,取3.8g粉末完全溶于水后,与足量的硝酸银溶液反应后得到12.4g氯化银沉淀,则该混合物中的另一氯化物是( )
| A. | AlCl3 | B. | KCl | C. | CaCl2 | D. | LiCl |
13.不能判断甲比乙非金属性强的事实是( )
| A. | 常温下甲能与氢气直接化合,乙不能 | |
| B. | 甲的氧化物对应的水化物酸性比乙强 | |
| C. | 甲得到电子能力比乙强 | |
| D. | 甲、乙形成的化合物中,甲显负价,乙显正价 |
10.实验室配置100mL 1.0mol/L Na2CO3溶液,下列有关叙述正确的是( )
| A. | 用托盘天平称取28.6g Na2CO3•10H2O晶体 | |
| B. | 将Na2CO3固体放入容器瓶中,加水至刻度线 | |
| C. | 定容时俯视液面,所得溶液浓度偏低 | |
| D. | 加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 |
17.下列分散系中,适宜用过滤的方法将分散质与分散剂分离的是( )
| A. | 溶液 | B. | 胶体 | ||
| C. | 悬浊液 | D. | 互不相容的两种液体 |
6.固体X中可能含有MgCl2、Na2CO3、Na2SO3、KAlO2中的一种或几种.现取固体X进行实验,实验过程及现象如下:
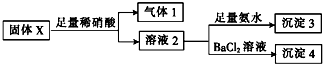
根据上述实验,下列说法正确的是( )

根据上述实验,下列说法正确的是( )
| A. | 气体1一定含NO可能含CO2 | |
| B. | 沉淀3一定含Mg(OH)2一定不含Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有MgCl2和Na2SO3,可能有KAlO2 |
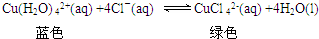
 、Ⅱ
、Ⅱ .
.
