题目内容
6.下列有关说法正确的是( )| A. | 常温下,向含Ag2S固体的溶液中滴加少量Na2S溶液,c(Ag+)、c(S2-)、Ksp(Ag2S)都减小 | |
| B. | 常温下,pH=10的K2CO3溶液和pH=4的FeCl3溶液中,水的电离程度后者小 | |
| C. | 含KHSO3和K2SO3的中性混合溶液中有c(K+)=c(HSO3-)+2c(SO32-) | |
| D. | 常温下,将pH=2的HX溶液稀释1000倍,稀释后溶液的pH一定为5 |
分析 A.溶度积只受温度的影响;
B.碳酸钠和氯化铁都促进水的电离;
C.根据电荷守恒判断;
D.如为弱酸,则加水促进电离.
解答 解:A.溶度积只受温度的影响,温度不变,则溶度积不变,故A错误;
B.碳酸钠和氯化铁都促进水的电离,pH=10的K2CO3溶液和pH=4的FeCl3溶液中,水的电离程度相同,故B错误;
C.溶液中存在c(H+)+c(K+)=c(HSO3-)+2c(SO32-)+c(OH-),溶液呈中性,c(H+)=c(OH-),则c(K+)=c(HSO3-)+2c(SO32-),故C正确;
D.如为弱酸,则加水促进电离,将pH=2的HX溶液稀释1000倍,稀释后溶液的pH小于5,故D错误.
故选C.
点评 本题考查较为综合,涉及难溶电解质的溶解平衡,弱电解质的电离以及盐类的水解等知识,为高频考点,侧重考查学生的分析能力和计算能力,注意把握弱电解质的电离特点,易错点为D,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.X、Y、Z、W为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如表所示,用化学用语回答下列问题.
请按要求回答下列问题:
(1)工业上制取X的单质的化学方程式:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)X、Y、W三种元素对应的离子半径由大到小的顺序为:Cl->Mg2+>Al3+.
(3)在25℃、101kPa下,已知13.5g的Y的固体单质在W的气体单质中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1676kJ/mol.
(4)甲中各原子都满足8电子稳定结构,其电子式为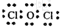 ;
;
(5)Sn与元素Z同主族,周期数比元素Z的大2.则Sn的原子序数为50;已知锡在水溶液中有Sn2+、Sn4+两种存在形式,且硫酸盐均可溶.酸性条件下,SnSO4可用作双氧水的去除剂,试写出所发生反应的离子方程式:Sn2++H2O2+2H+═Sn4++2H2O.潮湿环境中,镀锡铜如果锡层破损不能(填“能”或“不能”)形成铜绿.
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
(1)工业上制取X的单质的化学方程式:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)X、Y、W三种元素对应的离子半径由大到小的顺序为:Cl->Mg2+>Al3+.
(3)在25℃、101kPa下,已知13.5g的Y的固体单质在W的气体单质中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1676kJ/mol.
(4)甲中各原子都满足8电子稳定结构,其电子式为
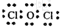 ;
;(5)Sn与元素Z同主族,周期数比元素Z的大2.则Sn的原子序数为50;已知锡在水溶液中有Sn2+、Sn4+两种存在形式,且硫酸盐均可溶.酸性条件下,SnSO4可用作双氧水的去除剂,试写出所发生反应的离子方程式:Sn2++H2O2+2H+═Sn4++2H2O.潮湿环境中,镀锡铜如果锡层破损不能(填“能”或“不能”)形成铜绿.
14.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将等物质的量的SO2与Cl2混合后,通入品红溶液 | 品红褪色 | SO2、Cl2都能使品红褪色 |
| B | 将Fe2O3溶于足量氢碘酸溶液,然后滴入淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
1.下列除去杂质(括号内为杂质)的方法中,正确的是( )
| A. | 乙烷(乙烯):将混合气体通过酸性高锰酸钾溶液,洗气 | |
| B. | 苯(苯酚):向混合液中加入适量的浓溴水,过滤 | |
| C. | 乙酸乙酯(乙酸、乙醇):向混合液中加入饱和碳酸钠溶液,分液 | |
| D. | 硝基苯(NO2):向溶有杂质的硝基苯中加入一定量的浓氢氧化钠溶液,振荡,分液 |
11.下列说法正确的是( )
| A. | 向海水中加入净水剂明矾可使海水淡化 | |
| B. | 合成纤维、光导纤维都属于有机高分子材料 | |
| C. | 利用加热的方法杀死人体内感染的埃博拉病毒 | |
| D. | “雾”是微小水滴或冰晶组成的气溶胶系统,“霾”中的灰尘对大气中的有害物质起吸附作用 |
18.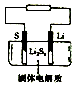 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )| A. | 放电时,锂在负极上发生氧化反应 | |
| B. | 放电时,正极的电极反应式为nS+2e-+2Li+=Li2Sn | |
| C. | 充电时,锂电极为阴极,与电源负极相连 | |
| D. | 充电时,理论上阳极失去2mol电子生成32g硫 |
15.短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,Z在周期表中处于周期序数等于族序数的位置.下列说法错误的是( )
| X | Y | |||
| Z | W |
| A. | 原子半径:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Z与Y的简单离子的电子层结构相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | X的简单氢化物与Y的氢化物化合产物中含有离子键和共价键 |
16.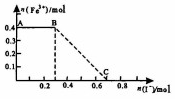 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )| A. | 参加反应的铁粉为0.4mol | |
| B. | 氧化性:HNO3>I2 | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | 稀硝酸的浓度为0.5mol/L |
 A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: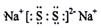 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.