题目内容
9. X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )| A. | X 元素位于ⅥA | B. | A 不能溶解于 B 中 | ||
| C. | B 的沸点高于 C 的沸点 | D. | A 和 C 不可能发生氧化还原反应 |
分析 B和C均为10电子分子,应该为氢化物,由转化关系可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,原子半径Y>X,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素;由转化关系,单质X、Y反应生成A,单质Y、Z生成B,则Y应为N元素、X应为O元素,则A为NO、B为H2O、C为NH3,验证符合转化关系,据此进行解答.
解答 解:B和C均为10电子分子,应该为氢化物,由转化关系可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,原子半径Y>X,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素;由转化关系,单质X、Y反应生成A,单质Y、Z生成B,则Y应为N元素、X应为O元素,则A为NO、B为H2O、C为NH3,验证符合转化关系,
A.X为O元素,原子序数为8,最外层含有6个电子,处于ⅥA族,故A正确;
B.A为NO、B为水,NO不溶于水,故B正确;
C.B为H2O、C为NH3,常温下,水为液体,氨气为气态,水的沸点更高,故C正确;
D.A为NO、C为NH3,NH3与NO可以发生反应生成氮气与水,故D错误;
故选D.
点评 本题考查元素及无机物的推断、元素化合物性质等,难度中等,推断元素与物质是解题的关键,注意掌握常见10电子物质,利用猜测验证法进行推断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.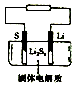 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )| A. | 放电时,锂在负极上发生氧化反应 | |
| B. | 放电时,正极的电极反应式为nS+2e-+2Li+=Li2Sn | |
| C. | 充电时,锂电极为阴极,与电源负极相连 | |
| D. | 充电时,理论上阳极失去2mol电子生成32g硫 |
19.某溶液中只可能含有K+、Al3+、Br-、OH-、CO32-、SO32-中的一种或几种.取样,滴加足量氯水,有气泡产生,溶液变为橙色;向橙色溶液中加BaCl2溶液无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | Br- | B. | OH- | C. | K+ | D. | Al3+ |
16.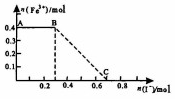 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )| A. | 参加反应的铁粉为0.4mol | |
| B. | 氧化性:HNO3>I2 | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | 稀硝酸的浓度为0.5mol/L |
4.镍氢电池(NiMH)目前己经成为混合动力汽车的一种主要电池类型.NiMH中的M 示储氢金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M═NiOOH+MH 下列说法正确的是( )
| A. | 放电过程中,正极的电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时,电子由负极→正极→电解质溶液→负极,形成闭合回路 | |
| C. | 充电时,阴极附近溶液pH 降低 | |
| D. | 充电过程中,OH-从阳极向阴极迁移 |
14.如图所示电化学装置(电极都是惰性电极)的判断合理的是( )
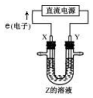

| A. | 若 Z 为饱和食盐水,则 X 是阴极 | |
| B. | 若 Z 为饱和食盐水,则碱在 X 附近生成 | |
| C. | 若 Z 为氯化铜溶液,Y 附近能得到氯气 | |
| D. | 若 Z 为氯化铜溶液,X 附近发生氧化反应 |
1.某有机物的球棍模型如图所示,下列有关说法中不正确的是( )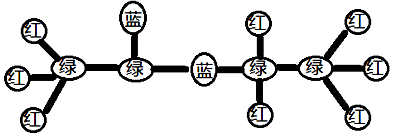

| A. | 该有机物的同分异构体中能够与碳酸氢钠溶液反应产生气体的不同结构有两种 | |
| B. | 实验室制备该有机物的反应类型与乙烯和溴的四氯化碳溶液反应的反应类型相同 | |
| C. | 1mol该有机物与足量的NaOH溶液反应,消耗的氢氧化钠的物质的量为1mol | |
| D. | 当该有机物与丙烷的总物质的量不变时,无论二者以何种比例混合,完全燃烧的耗氧量为定值 |
18.将0.1mol天然碱(2Na2CO3•NaHCO3•2H2O)溶于水配成1L溶液,下列关于该溶液的说法正确的是( )
| A. | c(CO32-)+c(HCO3-)=0.3mol•L-1 | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H-) | ||
| C. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | D. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
17.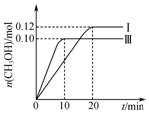 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )| 容器 | 温度/℃ | 起始物质的量/mol | ||
| CO(g) | H2(g) | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0 |
| Ⅱ | T1 | 0 | 0 | 0.4 |
| Ⅲ | T2 | 0.2 | 0.4 | 0 |
| A. | 在前20 min内,容器Ⅰ中反应的平均速率为v(H2)=0.012 mol•L-1•min-1 | |
| B. | 达到平衡后,容器Ⅰ中再充入0.20 mol CO和0.20 mol CH3OH,此时v(正)>v(逆) | |
| C. | 达到平衡时,容器Ⅱ中的压强一定大于容器Ⅰ中的压强的两倍 | |
| D. | 将容器Ⅲ改为绝热容器,实验起始温度为T2,达到平衡时,CO的转化率小于50% |