题目内容
5.钒的化合物常用于制作催化剂和新型电池.回答下列问题:(1)金属钒可由铝热反应制得.已知25℃、101kPa时,
4A1(s)+3O2(g)=2Al2O3 (s)△H1=a kJ•mol-1
4V(s)+5O2(g)=2V2O5(s)△H2=b kJ•mol-1
则用铝热反应冶炼金属V(s)的热化学方程式为10Al(s)+3V2O5(s)═5Al2O3(s)+6V(s)△H=(2.5a-l.5b)kJ•mol-1 .
(2)V2O5为橙黄至砖红色固体,无味、有毒,微溶于水,是许多有机和无机反应的催化剂.图1表示的是25℃时,部分含钒微粒的存在形式、浓度和存在的pH范围(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未准确确定.

①V2O5溶于足量2mol•L-1NaOH溶液中,发生反应的离子方程式为V2O5+6OH-═2VO43-+3H2O,向反应后的溶液中,滴加硫酸溶液至过量(pH<1)的过程中,开始溶液保持澄淸,滴加一段时间后,观察到有橙黄色沉淀产生,继续滴加硫酸溶液,沉淀又消失.则沉淀消失过程中发生反应的化学方程式为V2O5+H2SO4═(VO2)2SO4+H2O.
②上述滴加硫酸溶液的过程中,先后发生如图2的反应:
则“X所示区域溶液中的离子”不可能是b(填序号);
a.V3O93-b.V4O103- c.V4O124-
(3)V2O5是反应2SO2+O2?2SO3的催化剂.其他条件不变,加入V2O5后,该反应的速率加快的原因
是加入V2O5后,反应路径发生改变,反应的活化能降低,反应速率加快;恒温恒压下,加人V2O5,该反应的平衡常数不变 (填“增大”、“减小”或“不变”);
(4)图3所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过.电池放电时,负极区溶液的pH将增大(填“增大”、“减小”或“不变”),电池充电时,阳极的电极反应式为VO2+-e-+H2O═VO2++2H+.
分析 (1)①4A1(s)+3O2(g)=2Al2O3 (s)△H1=a kJ•mol-1
②4V(s)+5O2(g)=2V2O5(s)△H2=b kJ•mol-1
盖斯定律计算,(①×5-②×3)×$\frac{1}{2}$得到用铝热反应冶炼金属V(s)的热化学方程式;
(2)①V2O5溶于足量2mol•L-1NaOH溶液中生成Na3VO4和水;沉淀消失过程中发生反应是V2O5和硫酸反应生成(VO2)2SO4和H2O;
②上述滴加硫酸溶液的过程中,先后发生如图2的反应,结合图象中微粒存在的PH分析判断;
(3)催化剂降低反应的活化能加快反应速率;平衡常数随温度变化;
(4)钒液流电池放电时负极发生氧化反应,正极发生还原反应,充电时,阳极发生氧化反应.
解答 解:(1)①4A1(s)+3O2(g)=2Al2O3 (s)△H1=a kJ•mol-1
②4V(s)+5O2(g)=2V2O5(s)△H2=b kJ•mol-1
盖斯定律计算,(①×5-②×3)×$\frac{1}{2}$得到用铝热反应冶炼金属V(s)的热化学方程式为:10Al(s)+3V2O5(s)═5Al2O3(s)+6V(s)△H=(2.5a-l.5b)kJ•mol-1 ,
故答案为:10Al(s)+3V2O5(s)═5Al2O3(s)+6V(s)△H=(2.5a-l.5b)kJ•mol-1;
(2)①图可知碱性条件下,以VO43-存在,V2O5溶于足量2mol•L-1NaOH溶液中生成Na3VO4和水,反应的离子方程式为:V2O5+6OH-═2VO43-+3H2O,沉淀消失过程中发生反应是V2O5和硫酸反应生成(VO2)2SO4和H2O,反应的化学方程式为:V2O5+H2SO4═(VO2)2SO4+H2O,
故答案为:V2O5+6OH-═2VO43-+3H2O;V2O5+H2SO4═(VO2)2SO4+H2O;
②上述滴加硫酸溶液的过程中,先后发生如图2的反应:H2VO4-缩水后,V的化合价不变,则“X所示区域溶液中的离子”不可能是V4O103-,选b,
故答案为:b;
(3)V2O5是反应2SO2+O2?2SO3的催化剂.其他条件不变,加入V2O5后,该反应的速率加快的原因是:加入V2O5后,反应路径发生改变,反应的活化能降低,反应速率加快,平衡常数只随温度变化,恒温恒压下,加人V2O5,该反应的平衡常数不变,
故答案为:加入V2O5后,反应路径发生改变,反应的活化能降低,反应速率加快;不变;
(4)钒液流电池放电时负极发生氧化反应,据图可知,电极反应式为V2+-e-=V3+,氢离子移向正极,正极发生还原反应,负极区溶液PH增大,充电时,阳极发生氧化反应,电极反应式为VO2+-e-+H2O=VO2++2H+;
故答案为:增大;VO2+-e-+H2O═VO2++2H+.
点评 本题考查了热化学方程式书写、图象分析判断、反应离子方程式书写、原电池和电解池原理等,主要是题干信息的分析应用,掌握基础是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | NO | B. | N2O | C. | N2O3 | D. | N2 |

已知:①有关金属离子形成氢氧化物沉淀时的pH如表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)写出钇矿石与氢氧化钠共熔时的化学方程式4Y2FeBe2Si2O10+32NaOH+O2=8Y(OH)3+2Fe2O3+8Na2SiO3+8Na2BeO2+4H2O.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸和b两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)已知10-2.7=2×10-3、10-3.7=2×10-4,则25℃时,反应Fe3++3H2O?Fe(OH)3+3H+
的平衡常数K=8×10-5.如何检验Fe3+是否沉淀完全取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若观察不到血红色,则说明Fe3+沉淀完全(回答操作方法,不需设计所用仪器).
(4)①写出生成草酸钇沉淀的化学方程式2 Y(OH)2(s)+2H2C2O4(aq)=Y2(C2O4)3(s)+6H2O(l);
②若H2C2O4和湿润的KClO3混合加热到60℃可制得国际公认的高效含氯消毒剂ClO2,写出反应中氧化剂和氧化产物的物质的量之比1:1.在热水中ClO2会发生反应生成Cl2和HClO2,写出反应的化学方程式6ClO2+2H2O=Cl2+4HClO2+3O2.
| A. | 2-乙基-1,3-丁二烯分子的键线式: | B. | 丙烷分子的比例模型: | ||
| C. | 甲醛的电子式: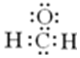 | D. | 聚丙烯的结构简式: |
①根据红外光谱图的分析可以初步判断有机物中含有哪些基团
②分子组成相差一个或几个CH2原子团的有机物是同系物
③同系物一定同类,且电子数之差-定为8的整数倍
④互为同分异构体的两种有机物由于结构不同,所以其物理性质有差别,化学性质也一定不相似.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中碳原子有两种杂化方式 | |
| C. | 丙烯分子至少有六个原子在同一平面上 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
| A. | SiO2 | B. | CO2 | C. | NaBr | D. | NH4Cl |

 .
. ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程 .
.