题目内容
9.如图为用含少量铁的废铜渣为原料生产胆矾的流程:
金属离子沉淀的pH
| 离子种类 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(2)在浸出时加入稀硫酸的作用提供酸性环境,使NO3-氧化铜
(3)试剂b为CuO或Cu(OH)2;滤渣c为Fe(OH)3.
(4)取样检验是为了证明没有Fe3+存在,其方法是向试样中滴加KSCN溶液,无明显现象.
(5)从滤液中得到胆矾的操作是蒸发浓缩、冷却结晶、过滤
(6)气体 a 可以被循环利用,用化学方程式表示气体 a 被循环利用的原理为2NO+O2=2NO2、3NO2+H2O=2HNO3+NO.
(7)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和 O2气体,且n (SO3):n (SO2)=1:2,写出硫酸铜受热分解的化学方程式3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑.
分析 废铜渣中铜和硝酸、硫酸反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,废铜渣中铁也发生类似反应,调节pH目的是使铁离子生成氢氧化铁沉淀,为不引入新杂质,故试剂b用CuO或Cu(OH)2,滤渣C为氢氧化铁,滤液中含硫酸铜;通过蒸发浓缩、冷却结晶析出硫酸铜晶体.
(1)铜与稀硝酸反应生成硝酸铜和NO气体;
(2)硝酸根离子在酸性条件下由有氧化性,稀硫酸的作用是提供酸性作用,使NO3-氧化铜;
(3)调节pH目的是使铁离子生成氢氧化铁沉淀,为不引入新杂质,故试剂b用CuO或Cu(OH)2,滤渣C为氢氧化铁;
(4)用KSCN溶液检验铁离子是否存在;
(5)通过蒸发浓缩、冷却结晶析出硫酸铜晶体;
(6)气体a为NO,NO与水反应生成二氧化氮,二氧化氮与水反应生成硝酸;
(7)硫酸铜受热分解生成CuO、SO2气体、SO3气体和 O2气体,且n (SO3):n (SO2)=1:2,根据质量守恒可写.
解答 解:(1)铜与稀硝酸反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)硝酸根离子在酸性条件下由有氧化性,稀硫酸的作用是提供酸性作用,使NO3-氧化铜,故答案为:提供酸性环境,使NO3-氧化铜;
(3)调节pH目的是使铁离子生成氢氧化铁沉淀,为不引入新杂质,故试剂b用CuO或Cu(OH)2,滤渣C为氢氧化铁;
故答案为:CuO或Cu(OH)2;Fe(OH)3;
(4)向试样中滴加KSCN溶液,无明显现象,说明溶液中不含铁离子;
故答案为:向试样中滴加KSCN溶液,无明显现象;
(5)硫酸铜滤液通过蒸发浓缩、冷却结晶、过滤硫酸铜晶体;
故答案为:蒸发浓缩、冷却结晶、过滤;
(6)气体 a 为NO气体,可以被循环利用,原理为2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(7)硫酸铜受热分解生成CuO、SO2气体、SO3气体和 O2气体,且n (SO3):n (SO2)=1:2,化学方程式为3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑,
故答案为:3CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+SO3↑+2SO2↑+O2↑.
点评 本题考查学生对工艺流程的理解、氮元素的有关氧化物的转化、离子检验、物质分离提纯等基本操作,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案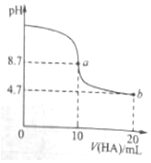 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(A-)+c(HA)=0.1mol•L-1 | |
| B. | b点所示溶液中c(HA)>c(A-) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | a、b两点所示溶液中水的电离程度a>b |
| A. | 称取12.5 g胆矾(CuSO4•5H2O),配成500 mL溶液 | |
| B. | 称取12.5 g胆矾(CuSO4•5H2O),加入500 mL水配成溶液 | |
| C. | 称取7.68 g无水硫酸铜粉末,加入480 mL水配成溶液 | |
| D. | 称取8.0 g无水硫酸铜粉末,加入500 mL水配成溶液 |
| A. | 4.9g | B. | 8.0g | C. | 9.8g | D. | 19.6g |
| A. | 常温下,c(H+)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| D. | 常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液中:K+、Na+、HCO3-、Ca2+ |
| A. | 化学键的断裂与形成一定伴随着电子的转移和能量变化 | |
| B. | 碘晶体是分子晶体,加热升华过程中只需克服分子间作用力 | |
| C. | 二氧化硅晶体属于原子晶体,每个Si通过共价键与4个O结合 | |
| D. | 氯化钠的电离是一个破坏离子键的过程 |
| A. | 蒸发、过滤、蒸馏、分液 | B. | 蒸馏、分液、蒸发、过滤 | ||
| C. | 蒸馏、过滤、蒸发、分液 | D. | 蒸发、分液、蒸馏、过滤 |
 .
.