题目内容
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 .(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .(用化学式表示)
(3)某化合物由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,请写出它的化学式: .
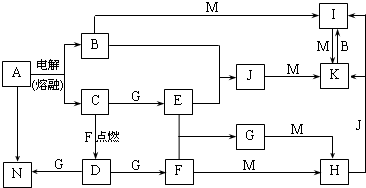
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
①请写出“N→⑥的单质”的化学方程式为 .
②X溶液与Y溶液反应的离子方程式为 .
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)某化合物由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,请写出它的化学式:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

①请写出“N→⑥的单质”的化学方程式为
②X溶液与Y溶液反应的离子方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置,可以①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,该化合物为HClO;
(4)M是仅含非金属元素的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,该化合物为HClO;
(4)M是仅含非金属元素的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应.
解答:
解:根据元素在周期表中的位置,可以①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,该化合物为HClO,故答案为:HClO;
(4)M是仅含非金属元素的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,
①“N→⑥的单质”的化学方程式为:2Al2O3(熔融)
4Al+3O2↑,
故答案为:2Al2O3(熔融)
4Al+3O2↑;
②X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,该化合物为HClO,故答案为:HClO;
(4)M是仅含非金属元素的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,
①“N→⑥的单质”的化学方程式为:2Al2O3(熔融)
| ||
故答案为:2Al2O3(熔融)
| ||
②X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+.
点评:本题考查元素周期表、元素周期律、无机物的推断等,注重对常考考点的考查,需要学生熟练掌握基础知识,题目难度中等.

练习册系列答案
相关题目
把2.5mol A和2.5mol B混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(g)?x C(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol?L-1?s-1,同时生成1mol D,下列叙述中错误的是( )
| A、达到平衡状态时A的转化率为50% |
| B、x=4 |
| C、达到平衡状态时容器内气体的压强与起始时压强比为6:5 |
| D、5s内B的反应速率v(B)=0.05 mol/(L?s) |
可以用来鉴别乙烯和乙烷的操作方法是( )
| A、混合气通过盛有酸性KMnO4溶液的洗气瓶 |
| B、通过装有过量溴水的洗气瓶 |
| C、混合气与足量溴蒸气混合 |
| D、混合气与过量氢气混合 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.8g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| D、3molNO2和足量H2O反应,转移1NA个电子 |
常温时,将0.1mol?L-1CH3COOH溶液加水稀释或加入少量的CH3COONa晶体时,下列说法中正确的是( )
| A、溶液中的PH值都增大 |
| B、溶液的导电能力都减弱 |
| C、加水稀释时,KW不变;加CH3COONa晶体时,KW增大 |
| D、加水稀释时,醋酸溶液中所有微粒浓度都减小(不考虑水分子浓度) |