题目内容
12.肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol.下列表示肼跟N2O4反应的热化学方程式,正确的是( )| A. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-542.7kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1059.3kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)=$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7kJ/mol |
分析 根据盖斯定律,①N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol
将方程式②×2-①得肼和N2H4反应的热化学方程式.
解答 解:肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气,
①N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol
将方程式②×2-①得肼和N2H4 反应的热化学方程式,2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1076.7 kJ/mol,
故选C.
点评 本题考查热化学方程式的书写,运用了盖斯定律,注意热化学方程式与化学方程式的区别.

练习册系列答案
相关题目
2.下列实验目的可以达到的是( )
| A. | 漂白粉与浓盐酸反应可制取氯气 | |
| B. | 用FeS与稀硝酸制取硫化氢 | |
| C. | 浓硫酸与碘化钠共热制取碘化氢 | |
| D. | 用浓溴水除去苯中溶有的少量的苯酚 |
3.从柑桔中炼制萜二烯 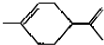 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H16 | |
| D. | 与过量的溴的CCl4溶液反应后产物为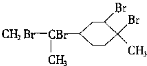 |
20.按酸、碱、盐、氧化物的顺序排列的一组物质是( )
| A. | H2SO4、Na2CO3、NaCl、CuO | B. | H2O、Ca(OH)2、HCl、Na2SO4 | ||
| C. | H2SO4、NaOH、Na2CO3、Fe2O3 | D. | NaOH、H2CO3、NaCl、CO2 |
17.下列反应中硫酸既不表现氧化性且又不表现还原性的是( )
| A. | 2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑ | |
| B. | 2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O | |
| C. | H2SO4(稀)+Zn═ZnSO4+H2↑ | |
| D. | H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
4.下列实验能获得成功的是( )
| A. | 苯与浓溴水反应制溴苯 | |
| B. | 在浓溴水中加几滴苯酚观察到白色沉淀 | |
| C. | 将乙醛滴入银氨溶液中制银镜 | |
| D. | 1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后加入40%乙醛溶液0.5mL,加热煮沸观察沉淀颜色 |
 A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C