题目内容
 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A、稀释前,c(HX)=0.01 mol/L |
| B、稀释10倍,HX溶液的pH=3 |
| C、a、b两点:c(X-)>c(Cl-) |
| D、溶液的导电性:a>b |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:根据盐酸是强酸,完全电离,HX为弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,以此解答该题.
解答:
解:A、HX为弱酸,pH=2时,c(HX)>0.01 mol/L,故A错误;
B、HX为弱酸,溶液稀释时,HX进一步电离,pH=2的HX,稀释10倍,HX溶液的pH<3,故B错误;
C、盐酸是强酸,完全电离,HX为弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,所以a、b两点:c(X-)>c(Cl-),故C正确;
D、盐酸是强酸,完全电离,HX为弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,溶液的导电性:a<b,故D错误;
故选C.
B、HX为弱酸,溶液稀释时,HX进一步电离,pH=2的HX,稀释10倍,HX溶液的pH<3,故B错误;
C、盐酸是强酸,完全电离,HX为弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,所以a、b两点:c(X-)>c(Cl-),故C正确;
D、盐酸是强酸,完全电离,HX为弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,HX浓度大,溶液稀释时,HX进一步电离,其溶液中离子浓度大于盐酸的离子浓度,溶液的导电性:a<b,故D错误;
故选C.
点评:本题考查强弱电解质溶液稀释时的pH、浓度变化,侧重于学生的分析能力的考查,注意加水促进弱电解质电离的特点,难度不大.

练习册系列答案
相关题目
X、Y、Z、R和W代表原子序数依次增大的5种短周期元素,X与Z、Y与W同主族,Y是地壳中含量最多的元素,W元素与X元素可以形成18电子的分子,R元素的简单离子是同周期元素中半径最小的,下列说法正确的是( )
| A、R元素最高价氧化物所对应的水化物具有两性,但不会溶于稀氨水 |
| B、Y分别可与X和Z形成原子个数比为1:1的化合物,且形成的化合物晶体类型相同 |
| C、Y的氢化物分子间存在氢键,因此Y的氢化物的稳定性大于W的氢化物的稳定性 |
| D、原子半径从小到大:X<Y<Z<R<W |
在生活、生产中,下列行为安全合理的是( )
| A、向燃着的酒精炉中添加酒精 |
| B、在含有大量铝粉尘的车间使用明火 |
| C、金属钠着火时用水灭火 |
| D、氨气泄漏时用湿毛巾捂住口鼻逃生 |
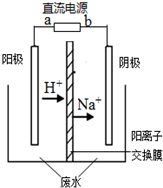 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )| A、电解过程中,阴极附近的乙醛被氧化 |
| B、阳极反应CH3CHO-2e-+H2O═CH3COOH+2H+ |
| C、若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 |
| D、现处理含1mol乙醛的废水,至少需转移1mol电子 |
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法不正确的是( )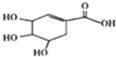

| A、分子式为C7H10O5 |
| B、1mol莽草酸与足量金属钠反应生成2molH2 |
| C、可发生加成反应、取代反应、氧化反应 |
| D、在水溶液中羧基和羟基均能电离出H+ |
在某容积一定的决斗容器中,有下列可逆反应2A(g)+B(g)?xC(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中正确的是( )


| A、x=2 |
| B、该反应是吸热反应 |
| C、P3>P4,y轴表示B的转化率 |
| D、P3<P4,y轴表示混合气体的密度 |
化学与生产生活、环境保护密切相关.下列说法中不正确的是( )
| A、食盐既可作调味品也可作食品防腐剂 |
| B、向海水中加入净水剂明矾可以使海水淡化 |
| C、加大石油、煤炭的开采速度,增加化石燃料的供应不利于“蓝天工程”的建设 |
| D、高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
下列化学用语的表示正确的是( )
A、CS2的比例模型: |
| B、乙醇的结构简式:C2H6O |
| C、核内有8个中子的碳原子:86C |
| D、HClO的结构简式:H-Cl-O |
 A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下: