题目内容
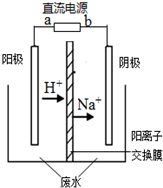 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )| A、电解过程中,阴极附近的乙醛被氧化 |
| B、阳极反应CH3CHO-2e-+H2O═CH3COOH+2H+ |
| C、若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 |
| D、现处理含1mol乙醛的废水,至少需转移1mol电子 |
考点:电解原理
专题:
分析:A.电解池阴极上发生的还原反应;
B.电解池阳极发生氧化反应,乙醛在阳极上失去电子生成乙酸;
C.a为正极,b为负极,负极发生氧化反应,通入甲烷;
D.1mol乙醛转化为乙醇或者转化为乙酸,转移2mol电子.
B.电解池阳极发生氧化反应,乙醛在阳极上失去电子生成乙酸;
C.a为正极,b为负极,负极发生氧化反应,通入甲烷;
D.1mol乙醛转化为乙醇或者转化为乙酸,转移2mol电子.
解答:
解:A.电解过程中,阴极附近的乙醛被还原,故A错误;
B.电解池阳极发生氧化反应,乙醛在阳极上失去电子生成乙酸,电极反应式为:CH3CHO-2e-+H2O═CH3COOH+2H+,故B正确;
C.连接电解池阴极的是原电池负极,负极上燃料失电子发生氧化反应,a为正极,b为负极,燃料电池的a极应通入空气,故C正确;
D.1mol乙醛转化为乙醇或者转化为乙酸,转移2mol电子,故D错误;
故选:AD.
B.电解池阳极发生氧化反应,乙醛在阳极上失去电子生成乙酸,电极反应式为:CH3CHO-2e-+H2O═CH3COOH+2H+,故B正确;
C.连接电解池阴极的是原电池负极,负极上燃料失电子发生氧化反应,a为正极,b为负极,燃料电池的a极应通入空气,故C正确;
D.1mol乙醛转化为乙醇或者转化为乙酸,转移2mol电子,故D错误;
故选:AD.
点评:本题考查了原电池和电解池的原理,侧重于学生的分析能力的考查,明确电极上发生的反应是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) |
| B、1mol?L-1CH3COONa溶液与0.5mol?L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) |
| C、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)+c(Fe2+)=0.3mol?L-1 |
| D、物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(NCN) |
CH2=CH-CH=CH2通过一步反应不能得到的物质是( )
A、 |
B、 |
C、 |
| D、CO2 |
一定质量的铁铝合金完全溶于过量的稀硝酸中,反应过程中共产生4.48LNO(标准状况下测定),若在反应后的溶液中加入足量的氢氧化物溶液,则生成沉淀的质量不可能是( )
| A、21.4g | B、18.7g |
| C、15.6g | D、7.8g |
25℃时,在浓度均为1mol/L的溶液中,各组离子一定能大量共存的是( )
| A、盐酸中:K+、Mg2+、Fe2+、MnO4-、 |
| B、NaOH溶液中:Cu2+、NH4+、SO42-、CO32- |
| C、FeCl3溶液中:Al3+、Na+、SCN-、SO42- |
| D、NaClO溶液中:K+、SO42-、OH-、NO3- |
下列说法正确的是( )
| A、常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C、在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D、物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A、稀释前,c(HX)=0.01 mol/L |
| B、稀释10倍,HX溶液的pH=3 |
| C、a、b两点:c(X-)>c(Cl-) |
| D、溶液的导电性:a>b |
化学与生活密切相关,下列有关说法正确的是( )
| A、制作航天服的聚酯纤维属于新型无机非金属材料 |
| B、银器久置后表面变暗,是因为发生了电化学腐蚀 |
| C、Li是最轻的金属,也是活动性很强的金属,是制造电池的理想物质 |
| D、海水提取溴、煤的液化、焰色反应都发生了化学变化 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | ||
| B、常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | ||
| C、标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | ||
D、将CO2通过Na2O2使其增重a克时,反应中转移电子数为
|