题目内容
17.下列不能形成配位键的组合是( )| A. | Ag+、NH3 | B. | BF3、NH3 | C. | Co3+、H2O | D. | Ag+、H+ |
分析 含有孤电子对和含有空轨道的原子之间能形成配位键,配位键属于共价键,根据配位键形成的条件分析,一方要提供空轨道,另一方提供孤电子对,据此答题.
解答 解:A.Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故A不选;
B.BF3中B原子有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,故B不选;
C.Co3+有空轨道,水分子中的O原子含有孤电子对,可以能形成配位键,故C不选;
D.Ag+、H+两种离子者没有孤电子对,所以不能形成配位键,故D选;
故选D.
点评 本题考查了配位键,明确配位键的形成条件是解本题关键,熟悉常见微粒中是否含有孤电子对或空轨道,只要符合配位键的形成条件就能形成配位键,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
8.某元素Mn+核外共有x个电子,该原子质量数为a,则该原子核内含有的中子数为( )
| A. | a-x+n | B. | a+x+n | C. | a-n+x | D. | a-x-n |
5.下列方法正确的是( )
①用过滤的方法除去食盐水中的泥沙
②用蒸馏的方法将自来水制成蒸馏水
③用酒精萃取碘水中的碘
④用淘洗的方法从沙里淘金.
①用过滤的方法除去食盐水中的泥沙
②用蒸馏的方法将自来水制成蒸馏水
③用酒精萃取碘水中的碘
④用淘洗的方法从沙里淘金.
| A. | ②③④ | B. | ①②④ | C. | ①③④ | D. | ①②③ |
2.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaHCO3溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
7.部分难溶物的颜色和常温下的Ksp如下表所示:
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ:装置如图所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ:把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为:2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为:Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |

实验Ⅰ:装置如图所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ:把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为:2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为:Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
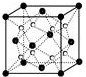 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.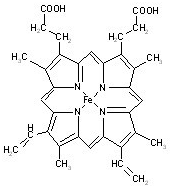 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.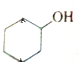 )中有3个手性碳原子.
)中有3个手性碳原子.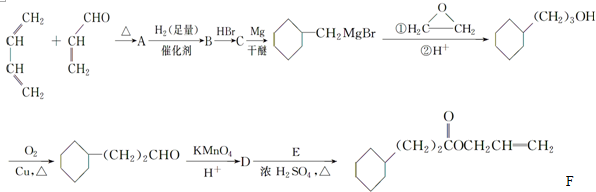
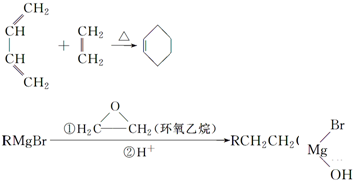
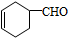 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键.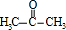 .
. .
. 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接: