题目内容
19.原子序数11-17的元素,自钠到氯,电子层数相同,最外层电子数从1增加到7,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,因此,氧化性逐渐增强,还原性逐渐减弱,金属性逐渐减弱,非金属性逐渐增强.分析 原子序数11-17的元素均在第三周期,从左向右原子半径减小,失去电子能力减弱,得到电子能力增强,以此来解答.
解答 解:原子序数11-17的元素,自钠到氯,电子层数相同,最外层电子数从1增加到7,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强,因此,氧化性逐渐增强,还原性逐渐减弱,金属性逐渐减弱,非金属性逐渐增强,
故答案为:相同;1;7;减小;增强;减弱;增强;增强;减弱;减弱;增强.
点评 本题考查周期表的结构及应用,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重于学生的分析与应用能力的考查,注意第三周期元素的性质为常考查点,题目难度不大.

练习册系列答案
相关题目
10.若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 1.6gNH2-离子所含质子数为NA | |
| C. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| D. | 9g D216O所含的中子数为4.5 NA |
11.有机物:①正戊烷 ②异戊烷 ③新戊烷 ④正丁烷⑤异丁烷,它们的沸点按由低到高的顺序排列正确的是( )
| A. | ④<⑤<①<②<③ | B. | ⑤<④<③<②<① | C. | ①<②<④<③<⑤ | D. | ①<②<③<④<⑤ |
8.某元素Mn+核外共有x个电子,该原子质量数为a,则该原子核内含有的中子数为( )
| A. | a-x+n | B. | a+x+n | C. | a-n+x | D. | a-x-n |
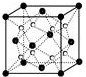 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
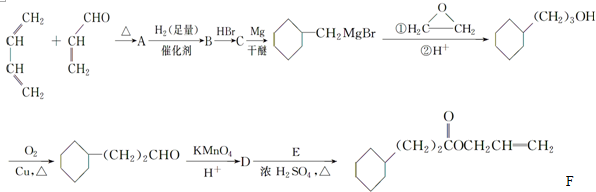
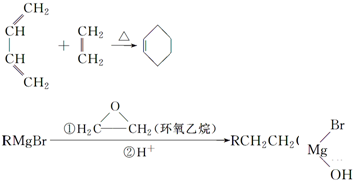
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.