题目内容
17.有A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,且A元素是卤族元素中非金属性最强的元素;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素原子的最外层电子数比次外层电子数多4.(1)写出下列元素的元素符号:AF,BNa,CH,DN,EC.
(2)写出C1、C2、C33种原子的符号:C1${\;}_{1}^{1}H$,C2${\;}_{1}^{2}H$,C3${\;}_{1}^{3}H$.
(3)A与B形成的化合物的化学式是NaF
(4)最常见的E原子与C2形成的分子中含6个中子.
分析 A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,且A元素是卤族元素中非金属性最强的元素,则A是F元素;
B为第IA族元素,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8,则B为Na元素;
C元素有3种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,则C为H元素;
D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸,则D为N元素;
E元素原子的最外层电子数比次外层电子数多4,则E是C元素;
结合题目分析解答.
解答 解:A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,且A元素是卤族元素中非金属性最强的元素,则A是F元素;
B为第IA族元素,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8,则B为Na元素;
C元素有3种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,则C为H元素;
D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸,则D为N元素;
E元素原子的最外层电子数比次外层电子数多4,则E是C元素;
(1)通过以上分析知,A、B、C、D、E分别是F、Na、H、N、C元素,
故答案为:F;Na;H;N;C;
(2)H元素有三种同位素氕氘氚,C1、C2、C33种原子的符号分别为${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$,故答案为:${\;}_{1}^{1}H$;${\;}_{1}^{2}H$;${\;}_{1}^{3}H$;
(3)A是F、B是Na元素,A与B形成的化合物的化学式是NaF,故答案为:NaF;
(4)最常见的C原子与H2形成的分子为甲烷,最常见的C原子含有6个质子、6个中子,最常见的氢原子中含有1个质子、不含中子,所以甲烷分子中含中子数为6,故答案为:6.
点评 本题考查位置结构性质相互关系及运用,为高频考点,侧重考查学生推断及知识综合运用能力,正确推断元素是解本题关键,知道同位素概念,题目难度不大.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案| A. | 过滤时,不可将悬浊液从烧杯中直接倒入漏斗中 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,现将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 只要是液体混合物就可以用蒸馏来分离 |
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大反应容器体积 | |
| D. | Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 |
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ②③⑤ |
| A. | 钾离子结构示意图: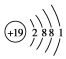 | |
| B. | KNO3溶液中,H+、Na+、Br-、I-能大量共存 | |
| C. | 可用于生产复合肥、配制炸药和制造瓷釉彩药 | |
| D. | KNO3溶液中混有少量NaCl时,可用重结晶的方法提纯,原因是KNO3溶解度大 |
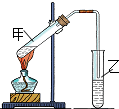 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题: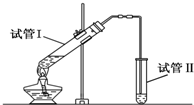 实验室用如图所示装置制备少量乙酸乙 酯.
实验室用如图所示装置制备少量乙酸乙 酯.