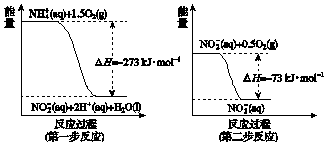
题目内容
6. 写出同时满足下列条件的E的一种同分异构的结构简式:
写出同时满足下列条件的E的一种同分异构的结构简式:
①能发生银镜反应
②分子中含有1个苯环且有3种不同环境的氢.
分析 能发生银镜反应,则一定含-CHO,且分子中含有1个苯环且有3种不同环境的氢,结构对称,E的分子中含12个H原子,则苯环连接3个间位的-CH2CHO,以此来解答.
解答 解:能发生银镜反应,则一定含-CHO,且分子中含有1个苯环且有3种不同环境的氢,结构对称,E的分子中含12个H原子,则苯环连接3个间位的-CH2CHO,可知满足条件的E的一种同分异构的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握醛的性质、有机物结构的对称性为解答的关键,侧重分析与应用能力的考查,注意分子中含3种H,题目难度中等.

练习册系列答案
相关题目
16.在强碱性的无色透明溶液中,能大量共存的离子是( )
| A. | Ca2+,Na+,NO3-,Cl- | B. | K+,Ba2+,Cl-,NO3- | ||
| C. | Na+,HCO3-,CO32-,K+ | D. | Na+,Cl-,K+,MnO4- |
17.亚硫酸盐在工业生产中冇广泛的应用,某同学在实验中对亚硫酸盐的制备和性质进行探究.
(1)Cu2SO3•CuSO3•2H2O是一种深红色固体,不溶于水和乙醇,100℃时发生分解,其制备实验装置如图所示.
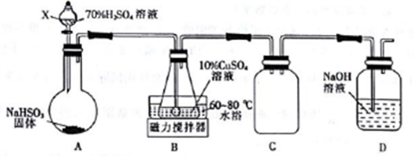
①仪器X的名称是分液漏斗.常温下用装置A制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是SO2易溶于水,用较浓的硫酸有利于SO2的逸出.
②装置C的作用是防止倒吸.
③装置B中发生反应的离子方程式为3Cu2++3SO2+6H2O═Cu2SO3•CuSO3•2H2O↓+8H++SO42-.
④从装置B中获得的固体需先用蒸馏水充分洗涤,再真空干燥,而不直接用烘干的方式得到产品,其原因是防止Cu2SO3•CuSO3•2H2O发生分解和被氧化.
(2)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;II.NaHSO3过量;III.NaClO过量.甲同学欲通过下列实验确定该反应属于哪一种情况,请完成表:
(3)请设计简单实验方案比较室温下NaHSO3浓液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小:常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若PH<7,则Ka>Kb;若pH>7,则Ka<Kb.
(1)Cu2SO3•CuSO3•2H2O是一种深红色固体,不溶于水和乙醇,100℃时发生分解,其制备实验装置如图所示.

①仪器X的名称是分液漏斗.常温下用装置A制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是SO2易溶于水,用较浓的硫酸有利于SO2的逸出.
②装置C的作用是防止倒吸.
③装置B中发生反应的离子方程式为3Cu2++3SO2+6H2O═Cu2SO3•CuSO3•2H2O↓+8H++SO42-.
④从装置B中获得的固体需先用蒸馏水充分洗涤,再真空干燥,而不直接用烘干的方式得到产品,其原因是防止Cu2SO3•CuSO3•2H2O发生分解和被氧化.
(2)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;II.NaHSO3过量;III.NaClO过量.甲同学欲通过下列实验确定该反应属于哪一种情况,请完成表:
| 实验操作 | 预期现象及结论 |
| 取上述反应后的混合溶液于试管 A中,滴加稀硫酸 | 若有气泡产生,则①II(填“I”“II”或“III”,下同)成立,若没有气泡产生,则②I或III成立 |
| 另取上述反应后的混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡 | ③溶液变为蓝色,则III成立 |
14.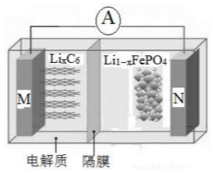 磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
 磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )| A. | 放电时Li+从右边移向左边 | |
| B. | 放电时M是负极,电极反应式为:C6x--xe-═6C | |
| C. | 充电时电路中通过0.5mol电子,消耗36gC | |
| D. | 充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-═Li1-xFeO4+xLi+ |
1.下列实验操作、现象和对应的实验结论均正确的是( )
| 实验操作和现象 | 实验结论 | |
| A | 检验某溶液中是否含有SO42-时,向溶液中滴加用盐 酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,然后靠近管道 | 有白色烟雾产生时说明管道发生泄漏 |
| C | 检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加 酸性KMnO4溶液,溶液变为无色 | 该溶液中一定含有Fe2+ |
| D | 向2mL0.1mol•L-1 硝酸银溶液中加入几滴0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1Na2S溶液,有黑色沉淀生成 | 该现象说明相同温度下Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
11.5.5g铁铝混合物与足量的盐酸反应,生成标准状况下的氢气4.48L,则混合物中Fe与Al的物质的量之比( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
18.下列反应可用离子方程式“H++OH-→H2O”表示的是( )
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | NH3•H2O溶液与HCl溶液混合 | ||
| C. | NaHCO3溶液与NaOH溶液混合 | D. | HNO3溶液与KOH溶液混合 |
15.设NA为阿伏加德罗常数的值,下列物质所含粒子数目为NA的是( )
| A. | 7 g乙烯和丙烯混合气体中的氢原子数目 | |
| B. | 0.5 mol Fe溶于过量HNO3溶液中,转移的电子数目 | |
| C. | 2.5 L 0.4 mol/L 的 Na2CO3 溶液中 CO32-数目 | |
| D. | 标准状况下,5.6 L CCl4含有的共价键数目 |