题目内容
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下
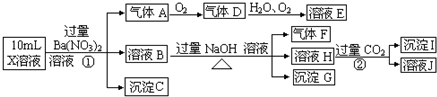
根据以上信息,回答下列问题
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子(Q)是 ,若要确定该Q(若不止一种,可任选一种)不存在,最可靠的化学方法是 .
(2)沉淀G的化学式为
(3)写出②中离子方程式: ,
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,当沉淀C物质的量 ,表明Q离子一定是 .

根据以上信息,回答下列问题
(1)上述离子中,溶液X中除H+外还肯定含有的离子是
(2)沉淀G的化学式为
(3)写出②中离子方程式:
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,当沉淀C物质的量
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此解答.
解答:
解:(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,检验方法是 取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+; 或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-,滴加KSCN溶液,若变红,则证明存在Fe3+,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;取原溶液少量于试管中,滴加硝酸酸化的硝酸银溶液,若产生白色沉淀则证明存在Cl-,取原溶液少量于试管中,滴加KSCN溶液,若变红,则证明存在Fe3+(写出一种即可);
(2)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成Fe(OH)3,故答案为:Fe(OH)3;
(3)②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),n(SO42-)=
=0.07mol,因此当n(SO42-)>0.07mol时,表明X溶液中一定有Fe3+,当n(SO42-)<0.07mol时,表明X溶液中一定有Cl-,故答案为:>0.07mol、Fe3+或<0.07mol,Cl-.
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;取原溶液少量于试管中,滴加硝酸酸化的硝酸银溶液,若产生白色沉淀则证明存在Cl-,取原溶液少量于试管中,滴加KSCN溶液,若变红,则证明存在Fe3+(写出一种即可);
(2)Fe2+离子被氧化为Fe3+离子,加入NaOH溶液后生成Fe(OH)3,故答案为:Fe(OH)3;
(3)②H为NaOH和NaAlO2混合物,通入过量二氧化碳后分别发生的反应为:CO2+OH-=HCO3-,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),n(SO42-)=
| 2×0.03mol+3×0.01mol+0.01mol+0.04mol |
| 2 |
点评:本题为考查离子组推断题,题目具有一定难度,本题解答时一定要紧扣反应现象,推断各离子存在的可能性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的( )
| A、NaOH(固体) |
| B、NaNO3 (固体) |
| C、NH4Cl(固体) |
| D、CH3COONa(固体) |
下列实验操作中正确的是( )
| A、为了节约火柴,用燃着的酒精灯引燃另一盏酒精灯 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水的大 |
| C、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| D、蒸馏操作时,应使用温度计水银球应放到溶液中测量溶液的温度 |
下列不属于蛋白质变性的是( )
| A、打针前用酒精消毒 |
| B、蛋白质溶液加入食盐变混浊 |
| C、用稀福尔马林浸泡种子 |
| D、用波尔多液(含硫酸铜)防止作物虫害 |
下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A、NaCl中有杂质Na2SO4(氯化钡) |
| B、FeSO4中有杂质CuSO4(铁粉) |
| C、KCl溶液中有少量K2CO3(硫酸) |
| D、CO2中有少量CO(灼热的氧化铜) |
异戊烷的结构简式为( )
| A、CH3CH2CH2CH2CH3 |
B、 |
C、 |
D、 |