题目内容
19.工业上用FeCl3溶液腐蚀印刷电路板,向腐蚀后的溶液中(含Fe3+、Cu2+、Fe2+、H+、Cl-等离子)加入指定物质,反应后溶液中大量存在的一组离子描述正确的是( )| A. | 加入过量Fe:Fe2+、Fe3+、Cl-、H+ | |
| B. | 加入过量H2O2和稀盐酸:Fe3+、Cu2+、H+、Cl- | |
| C. | 加入过量新制氯水:Fe3+、Cu2+、H+、Cl- | |
| D. | 加入过量CuO:Fe3+、Cu2+、H+、Cl- |
分析 A.Fe过量,反应后溶液中不会存在铁离子;
B.四种离子之间不反应,加入双氧水和稀盐酸也不反应;
C.四种离子之间不富裕,都不与氯水反应;
D.氢离子与氧化铜反应.
解答 解:A.Fe、Fe3+之间发生反应,加入过量Fe后不可能存在大量Fe3+,故A错误;
B.加入过量H2O2和稀盐酸后,Fe2+被氧化成Fe3+,反应后溶液中Fe3+、Cu2+、H+、Cl-可以大量共存,故B正确;
C.加入过量新制氯水,Fe2+被氧化成Fe3+,反应后溶液中Fe3+、Cu2+、H+、Cl-可以大量共存,故C正确;
D.CuO与H+反应,不能大量共存,故D错误;
故选BC.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
9.苯是一种重要的有机化工原料,广泛用于合成橡胶、塑料和医药等方面.下列关于苯的叙述正确的是( )
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
10.下列实验操作能达到相应实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 证明还原性:I->Fe2+ | 向FeI2和KSCN混合溶液中滴入少量氯水,再加入CCl4,振荡 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
7.下列反应中,属于吸热反应的是( )
| A. | C与水蒸气高温下制取水煤气 | B. | 铝与稀盐酸 | ||
| C. | 铝热反应 | D. | 甲烷与O2的燃烧反应 |
4.下列关于有机物的说法正确的是( )
| A. | 糖类和蛋白质都属于高分子化合物 | B. | 苯和聚乙烯均能发生加成反应 | ||
| C. | C5H11Cl有6种同分异构体 | D. | 石油分馏、煤干馏都可得到烃 |
11.下列说法不正确的是( )
| A. | 油脂是热值最高的营养物质,可以制造肥皂和油漆 | |
| B. | 利用二氧化碳制造全降解塑料,符合绿色化学理念 | |
| C. | 脱脂棉、滤纸、蚕丝的主要成分均为纤维素,完全水解能得到葡萄糖 | |
| D. | 酒精、福尔马林用于杀菌消毒的原理都是使蛋白质变性 |
8.下列反应属于取代反应的是( )
| A. | 乙醇与浓H2SO4共热170℃ | B. | 乙烯使溴水褪色 | ||
| C. | 甲苯与浓硫酸、浓硝酸混合 | D. | 苯与Cl2一定条件生成六氯环己烷 |
13.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态N2O4.已知:①2O2(g)+N2(g)=N2O4(l)△H1 ②N2(g)+2H2(g)=N2H4(l)△H2 ③O2(g)+2H2(g)=2H2O(g)△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048kJ/mol
(1)上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态N2O4反应生成液态水时放出的热量是612kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(4)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+2H2O(g)?CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如表所示:
试通过计算得出该反应的△H=+162 kJ/mol.
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048kJ/mol
(1)上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态N2O4反应生成液态水时放出的热量是612kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(4)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+2H2O(g)?CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
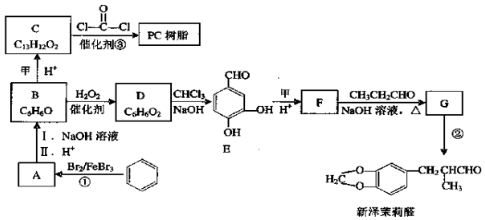
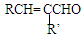 +H2O
+H2O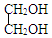 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$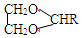 +H2O
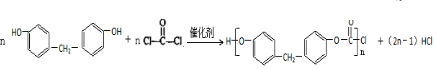
+H2O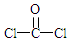 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$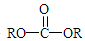 +2HCl
+2HCl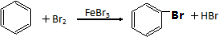 .
.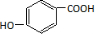 .
.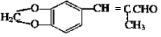 .
. .
.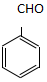 )为原料,选用必要的无机试剂合成
)为原料,选用必要的无机试剂合成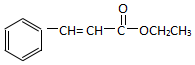 ,写出合成路线
,写出合成路线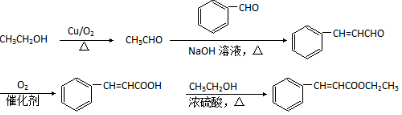 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).