题目内容
10.下列实验操作能达到相应实验目的是( )| 选项 | 实验目的 | 实验操作 |
| A | 证明还原性:I->Fe2+ | 向FeI2和KSCN混合溶液中滴入少量氯水,再加入CCl4,振荡 |
| B | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加氨水并不断搅拌 |
| C | 分离苯和四氯化碳 | 用分液漏斗进行分液 |
| D | 制取NH3 | 直接加热NH4Cl固体,用向下排空气法收集气体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向FeI2和KSCN混合溶液中滴入少量氯水,再加入CCl4,如四氯化碳层变紫色,且溶液不变红色,可说明生成碘单质.
B.向饱和FeCl3溶液中滴加氨水并不断搅拌,生成氢氧化铁沉淀;
C.苯和四氯化碳互溶;
D.加热NH4Cl固体,分解生成的氨气和氯化氢又可生成氯化铵.
解答 解:A.向FeI2和KSCN混合溶液中滴入少量氯水,再加入CCl4,如四氯化碳层变紫色,且溶液不变红色,可说明亚铁离子没有被氧化,生成碘单质,可证明还原性:I->Fe2+,故A正确;
B.向饱和FeCl3溶液中滴加氨水并不断搅拌,生成氢氧化铁沉淀,如制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液,故B错误;
C.苯和四氯化碳互溶,应用蒸馏的方法分离,故C错误;
D.氯化铵不稳定,加热NH4Cl固体,分解生成的氨气和氯化氢在温度稍低时又可生成氯化铵,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重考查学生的分析能力和实验能力,涉及物质的检验、分离以及制备实验,把握实验原理为解答的关键,题目难度中等,注意实验方案的评价性、操作性分析.

练习册系列答案
相关题目
1.由乙醇制取乙二酸乙二酯时,最简便的流程需要下列哪些反应,其正确的顺序是( )
①水解;②加成;③氧化;④还原;⑤消去;⑥酯化;⑦中和.
①水解;②加成;③氧化;④还原;⑤消去;⑥酯化;⑦中和.
| A. | ①②③⑤⑦ | B. | ⑤②①③⑥ | C. | ⑤②①④⑦ | D. | ①②⑤③⑥ |
18.元素是构成我们生活的世界中一切物质的“原材料”.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
上述科学家的研究按照时间先后排序合理的是②③④①(填数字序号).
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示.
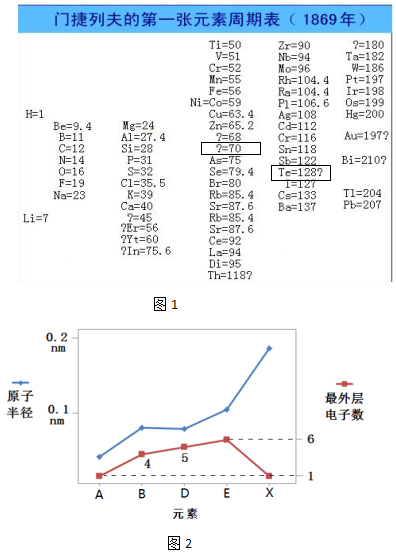
①门捷列夫将已有元素按照相对原子质量排序,同一横行(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是相对原子质量为70的元素,第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量不是128.
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是
A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A、B、D、E、X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示:
①上述七种元素中,处于第二周期的有C、N(用元素符号表示,下同),X在周期表中的位置是第三周期,第ⅠA族.
②E的原子结构示意图为 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.
③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑.
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3,二者酸性前者弱于(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因:C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C.
(1)自18世纪以来,科学家们不断探索元素之谜.通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系.下面列出了几位杰出科学家的研究工作.
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图1所示.

①门捷列夫将已有元素按照相对原子质量排序,同一横行(填“横行”或“纵列”)元素性质相似.结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是相对原子质量为70的元素,第5列方框中“Te=128?”的问号表达的含义是怀疑Te的相对原子质量不是128.
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满.而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化.其本质原因是
A(填字母序号).
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A、B、D、E、X、Y、Z七种短周期元素.X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应.Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5.其余信息如图2所示:
①上述七种元素中,处于第二周期的有C、N(用元素符号表示,下同),X在周期表中的位置是第三周期,第ⅠA族.
②E的原子结构示意图为
 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑.
④B和D的最高价氧化物的水化物的化学式分别为H2CO3、HNO3,二者酸性前者弱于(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因:C原子和N原子具有相同电子层,N原子的核电荷数多于C,N原子半径小于C,N原子核对最外层电子的吸引作用大于C,故N非金属性强于C.
5.X、Y、Z、W、M均为短周期元素.其中,X、Y同主族,Y元素形成的一种单质可保存在冷水中;Z、W、Y、M是第三周期连续的四种元素,原子半径依次减小.下列叙述不正确的是( )
| A. | X的液态单质可在医疗上用于冷冻麻醉 | |
| B. | Y、M两元素气态氢化物的稳定性:Y<M | |
| C. | 工业上制备Z的单质可电解其熔融态的氧化物 | |
| D. | 氧化物XO2与MO2均具有漂白性,且漂白原理相同 |
15.工业上在一定条件下将丙烷脱氢制丙烯.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
则丙烷脱氢反应的热化学方程式为CH3CH2CH3(g)?CH2=CHCH3(g)+H2(g)△H=+126kJ/mol.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
2.已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )

| A. | 甲为C,X为O2 | B. | 甲为SO2,X为NaOH溶液 | ||
| C. | 甲为Fe,X为Cl2 | D. | 甲为硝酸溶液,X为Fe |
19.工业上用FeCl3溶液腐蚀印刷电路板,向腐蚀后的溶液中(含Fe3+、Cu2+、Fe2+、H+、Cl-等离子)加入指定物质,反应后溶液中大量存在的一组离子描述正确的是( )
| A. | 加入过量Fe:Fe2+、Fe3+、Cl-、H+ | |
| B. | 加入过量H2O2和稀盐酸:Fe3+、Cu2+、H+、Cl- | |
| C. | 加入过量新制氯水:Fe3+、Cu2+、H+、Cl- | |
| D. | 加入过量CuO:Fe3+、Cu2+、H+、Cl- |
20.下列说法中正确的是( )
| A. | 含有羟基的有机物称为醇 | B. | 能发生银镜反应的有机物都是醛 | ||
| C. | 苯酚俗称石炭酸,酸性比碳酸强 | D. | C3H6和C4H8不一定是同系物 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.