题目内容
16.下列关于工业生产HCl的说法正确的是( )| A. | 合成塔的燃烧器内中心管道内通入氢气 | |
| B. | 应当控制氯气的用量少于氢气 | |
| C. | 氯气在氢气中燃烧,火焰为蓝色 | |
| D. | 反应需要点火才能进行,因此是一个吸热反应 |
分析 A、中心管道内通入氯气,从侧管中通入氢气可以将氯气包围,使氯气充分反应,减小污染环境;
B、氯气有毒能污染环境分析;
C、氯气在氢气中燃烧火焰为苍白色;
D、反应是放热反应;
解答 解:A、中心管道内通入氯气,从侧管中通入氢气可以将氯气包围,使氯气充分反应,故A错误;
B、氯气有毒能污染环境,从侧管中通入氢气可以将氯气包围,使氯气充分反应,减小污染环境,应当控制氯气的用量少于氢气,故B正确;
C、氯气在氢气中燃烧火焰为苍白色,生成氯化氢,故C错误;
D、氯气和氢气发生的化合反应生成氯化氢气体,反应是放热反应,故D错误;
故选B.
点评 本题考查了工业制备盐酸的原理分析判断,主要是气体量的分析和反应特征理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列醇或卤代烃在合适条件下,也不能产生烯烃的是( )
| A. |  | B. | CH3Br | C. |  | D. |  |
11.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 常温常压下,15gCH3+所含的电子数为9NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 某密闭容器中盛有0.2mol SO2和0.1mol O2,充分反应,生成SO3分子数为0.2NA |
1.向含有下列离子的溶液中分别加入烧碱固体(溶液的体积变化可忽略),能引起下列离子浓度增大的是( )
| A. | HCO3- | B. | Cl- | C. | OH- | D. | Cu2+ |
8.关于维生素的下列说法正确的是( )
| A. | 维生素一般可分为脂溶性和水溶性 | |
| B. | 维生素容易在内积存,主要积存在肝脏 | |
| C. | 维生素容易被人体吸收,多余的随尿排出体外,不易在体内积存,所以容易缺乏 | |
| D. | 维生素C可以防治夜盲症 |
5.V L浓度为1mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
| A. | 通入标准状况下的HCl气体22.4VL | |
| B. | 将溶液加热浓缩到0.5VL | |
| C. | 加入10mol•L-1的盐酸0.2V L,再稀释至1.5VL | |
| D. | 加入VL3 mol•L-1的盐酸混合均匀 |
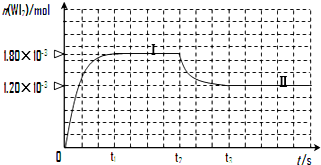 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)

