题目内容
分别将0.2mol的Na、Mg、Al投入500mL浓度为为0.2mol/L的盐酸中,生成氢气的质量比为( )
| A、1:2:3 |
| B、.1:1:1 |
| C、3:2:1 |
| D、2:1:1 |
考点:化学方程式的有关计算
专题:计算题
分析:金属均为0.2mol,n(HCl)=0.5L×0.2mol/L=0.1mol,由2Na~2HCl~H2,2Mg~4HCl~2H2,2Al~6HCl~3H2计算,钠与盐酸的反应中,以Na的物质的量计算.
解答:
解:金属均为0.2mol,n(HCl)=0.5L×0.2mol/L=0.1mol,则
2Na~2HCl~H2,
0.2 0.1
2Mg~4HCl~2H2,
0.1 0.05
2Al~6HCl~3H2,
0.1 0.05
则生成氢气的质量比等于物质的量之比,均为0.1mol:0.05mol:0.05mol=2:1:1,
故选D.
2Na~2HCl~H2,
0.2 0.1
2Mg~4HCl~2H2,
0.1 0.05
2Al~6HCl~3H2,
0.1 0.05
则生成氢气的质量比等于物质的量之比,均为0.1mol:0.05mol:0.05mol=2:1:1,
故选D.
点评:本题考查化学反应方程式的计算,为高频考点,把握钠和水反应的特点及金属与酸的反应中量少的物质完全反应为解答的关键,侧重分析与计算能力的考查,注意过量计算的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
| A、油脂的摄入有利于人体对某些维生素的吸收 |
| B、铝硅酸盐分子筛能用于分离提纯气体或液体混合物,不能做干燥剂和催化剂 |
| C、水在4℃时有(H2O)2存在,两个水分子间以某种特殊的分子间作用力相结合 |
| D、利用乙醇的还原性,可用经硫酸酸化处理的三氧化铬硅胶检验酒后驾车 |
有关电解质的下列叙述中正确的是( )
| A、盐酸的导电性比乙酸溶液的导电性强,说明乙酸是弱酸 |
| B、因为氧化钾溶于水能导电,所以氧化钾是电解质 |
| C、强电解质中一定含有离子键,弱电解质中一定含有弱极性共价键 |
| D、某物质能导电,说明该物质一定含有能自由移动的带电荷的微粒 |
将0.05mol SO2(g)和0.03mol O2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol?L-1.以下表述正确的是( )
| A、该条件下反应的平衡常数为1.6×103 |
| B、通常情况下,该反应一定能自发进行 |
| C、题给条件下,O2的转化率是20% |
| D、当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
 如图为冰晶体的结构模型,大球代表O原子,小球代表H原子.下列有关说法正确的是( )
如图为冰晶体的结构模型,大球代表O原子,小球代表H原子.下列有关说法正确的是( )| A、冰晶体中每个水分子与另外四个水分子形成四面体 |
| B、冰晶体具有空间网状结构,是原子晶体 |
| C、水分子间通过H-O键形成冰晶体 |
| D、冰晶体熔化时,水分子之间的空隙增大 |
根据元素周期律判断,下列元素原子半径最小的是( )
| A、Cl | B、S | C、Na | D、Mg |
某有机物的结构简式为: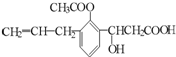 ,则此有机物可发生的反应类型有( )
,则此有机物可发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚 ⑧中和.
 ,则此有机物可发生的反应类型有( )
,则此有机物可发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚 ⑧中和.
| A、①②④⑤⑥⑦⑧ |
| B、②③④⑤⑥⑧ |
| C、②③④⑤⑥⑦⑧ |
| D、①②③④⑤⑥⑦⑧ |