题目内容
6.用NA代表阿伏加德罗常数,相关说法不正确的是( )| A. | 常温下6.5g Zn与足量浓盐酸反应生成H2的分子数为0.1NA | |
| B. | 标准状况下,2.24L NH3所含电子数为NA | |
| C. | 500mL 1mol•L-1的K2SO4溶液中含有K+数目为NA | |
| D. | 1mol NH3溶于水后所得氨水中,OH-的数目为NA |
分析 A、求出锌的物质的量,然后根据1mol锌生成1mol氢气来分析;
B、求出氨气的物质的量,然后根据1mol氨气中含10mol电子来分析;
C、求出硫酸钾的额物质的量,然后根据1mol硫酸钾中含2mol钾离子来分析;
D、一水合氨是弱碱.
解答 解:A、6.5g锌的物质的量为0.1mol,而1mol锌生成1mol氢气,故0.1mol锌生成0.1mol氢气即0.1NA个,故A正确;
B、标况下2.24L氨气的物质的量为0.1mol,而1mol氨气中含10mol电子,故0.1mol氨气中含1mol电子即NA个,故B正确;
C、溶液中的硫酸钾的物质的量n=CV=1mol/L×0.5L=0.5mol,而1mol硫酸钾中含2mol钾离子,故0.5mol硫酸钾中含1mol钾离子即NA个,故C正确;
D、一水合氨是弱碱,不能完全电离,故溶液中的氢氧根的个数小于NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
16.下列变化属于物理变化的是( )
| A. | 用海带提取碘单质 | B. | 钢铁生锈 | ||
| C. | 油脂酸败 | D. | 蛋白质盐析 |
17.短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,X与W同主族,Y、Z族序数之和为11,Z原子最外层电子数是内层电子总数的3倍.下列说法不正确的是( )
| A. | 元素Z、W的简单离子的电子层结构相同 | |
| B. | 元素Y的简单气态氢化物的热稳定性比Z的弱 | |
| C. | W、Z两种元素形成的化合物中肯定不含共价键 | |
| D. | 由X、Y、Z三种元素形成化合物,其水溶液可能显碱性 |
14.工业上用反应 3Cl2+2NH3=N2+6HCl 检查氯气管道是否漏气,下列说法正确的是( )
| A. | 该反应属于复分解反应 | B. | 该反应中Cl2是还原剂 | ||
| C. | 该反应中NH3发生还原反应 | D. | 该反应生成1molN2有6mol电子转移 |
1.能降低反应所需的活化能的是( )
| A. | 降低温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 增加浓度 |
11.图为一种天然产物,具有一定除草功效.下列有关该化合物的说法正确的是 ( )
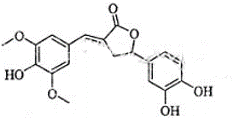

| A. | 分子中含有三种含氧官能团 | |
| B. | 1mol该化合物最多能与6molNaOH反应 | |
| C. | 既能与FeC13发生显色反应,也能和NaHCO3反应放出CO2 | |
| D. | 既可以发生取代反应,又能够发生加成反应. |
15.2014年在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性.下列有关说法正确的是( )
| A. | 高锰酸钾溶液和双氧水均可以将病毒氧化而达到消毒的目的 | |
| B. | 乙醇、次氯酸钠溶液的消毒原理相同 | |
| C. | 双氧水和次氯酸钠具有较强的腐蚀性,不能用于皮肤的消毒 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可发生反应:2NaClO+SO2+H2O═Na2SO3+HClO |
16.下列说法正确的是( )
| A. | Na2O2、MgO、Fe2O3均属碱性氧化物 | |
| B. | NaHCO3、NaAlO2、Na2CO3均属钠盐 | |
| C. | Al(OH)3、Fe(SCN)3、BaSO4均属难电离物质 | |
| D. | Al(OH)3、Fe(OH)3、Fe(OH)2均属碱 |