题目内容
1.能降低反应所需的活化能的是( )| A. | 降低温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 增加浓度 |
分析 只有催化剂能降低反应所需的活化能.
解答 解:压强、浓度只能改变单位体积的活化分子数目,不能改变活化能;降低温度,活化分子百分数减小,反应速率降低,但不是降低反应的活化能的原因,
使用催化剂,可改变反应历程,降低活化能,
故选C.
点评 本题考查化学反应速率的影响,难度不大,注意催化剂与其它影响因素的区别,把握影响化学反应速率的根据原因,学习中注意相关基础知识的积累.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
11.下列说法正确的是( )
| A. | 乙醇既可以发生催化氧化反应,又可以发生酯化反应 | |
| B. | 用溴水可以鉴别乙醇、乙酸和苯 | |
| C. | 糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素 | |
| D. | C5H10O属于醛类的同分异构体为六种 |
12. 某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )
某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )
 某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )
某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )| A. | 该反应的化学方程式为CO2+3H2?CH3OH+H2O | |
| B. | 从反应开始到3 min时,氢气的平均反应速率v(H2)=0.25 mol•L-1•min-1 | |
| C. | 在原容器中再充入1 mol H2能使CO2的转化率增大 | |
| D. | 恒温下,向反应体系中加入固体催化剂,反应产生的热量增加 |
9.从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
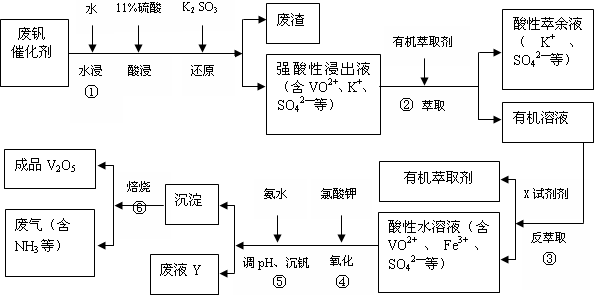
(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层)+n H2SO4(水层).
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;
③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为1.7;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.(已知:25℃时,Ksp(Fe(OH)3)=2.6×10-39.)
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:
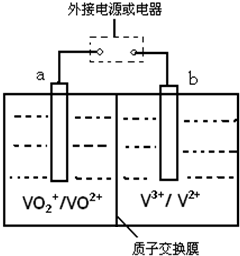
①全矾液流电池的工作原理为:
VO2++V2++2H+ $?_{()电}^{()电}$ VO2++H2O+V3+
(请在可逆符号两侧的括号中填“充”、“放”)
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O;当有1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”)

(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层)+n H2SO4(水层).
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;
③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:

①全矾液流电池的工作原理为:
VO2++V2++2H+ $?_{()电}^{()电}$ VO2++H2O+V3+
(请在可逆符号两侧的括号中填“充”、“放”)
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O;当有1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”)
6.用NA代表阿伏加德罗常数,相关说法不正确的是( )
| A. | 常温下6.5g Zn与足量浓盐酸反应生成H2的分子数为0.1NA | |
| B. | 标准状况下,2.24L NH3所含电子数为NA | |
| C. | 500mL 1mol•L-1的K2SO4溶液中含有K+数目为NA | |
| D. | 1mol NH3溶于水后所得氨水中,OH-的数目为NA |
13.下列说法正确的是( )
| A. | 在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热 量,则C的燃烧热为110.5 kJ/mol | |
| B. | 在10l k Pa时l mol H2完全燃烧生成液态水放出285.8 kJ热量,H2燃烧热为-285.8KJ/mol | |
| C. | 鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+oH-(aq)=H2O(l)△H=-57.3KJ/mol,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
11.禁止用工业酒精配置饮料,是因为工业酒精中含有某种毒性很强的醇,该醇是( )
| A. | 甲醇 | B. | 乙二醇 | C. | 丙三醇 | D. | 异戊醇 |
 在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示:
在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示: