题目内容
4.温度为25℃时,将0.46g钠投入到2000g水中充分反应,假设反应后溶液体积为2000mL,则该溶液的pH为( )| A. | 1 | B. | 13 | C. | 12 | D. | 10 |
分析 发生反应:2Na+2H2O=2NaOH+H2↑,根据化学方程式计算生成NaOH的物质的量,根据c=$\frac{n}{V}$计算氢氧化钠浓度,再根据KW=c(H+)•c(OH-)计算c(H+),再根据pH=-lgc(H+)计算溶液pH.
解答 解:设生成NaOH的物质的量为n,则:
2Na+2H2O=2NaOH+H2↑
46g 2mol
0.46g n(NaOH)
n(NaOH)=$\frac{0.46g×2mol}{46g}$=0.02mol,
故c(OH-)=c(NaOH)=$\frac{0.02mol}{2L}$=0.01mol/L,
反应后溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,
则反应后溶液的pH=-lgc(H+)=-lg10-12=12,
故选C.
点评 本题考查溶液pH的计算,题目难度不大,明确发生反应实质为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
14.下列关于有机物的说法不正确的是( )
| A. | C3H2Cl6有四种同分异构体 | |
| B. |  中所有原子可能共平面 中所有原子可能共平面 | |
| C. | 乙醇被酸性KMnO4溶液充分氧化的化学方程式为5CH3CH2OH+2KMnO4+3H2SO4→5CH3CHO+K2SO4+2MnSO4+8H2O | |
| D. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种 |
15.能正确表示下列反应离子方程式的是( )
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+═3Cl2↑+3H2O |
12.下列有关物质的分类或归类正确的是( )
| A. | 混合物:草木灰、漂白粉、水玻璃、水银 | |
| B. | 化合物:纯碱、烧碱、小苏打、食醋 | |
| C. | 电解质:明矾、石膏、冰醋酸、硫酸钡 | |
| D. | 同素异形体:金刚石、石墨、C60、CO |
19.芳香类化合物C8H8O2能与NaHCO3溶液反应生成CO2,该芳香烃化合物连在碳原子上的氢原子被氯原子取代后的一氯代物共有(不含立体结构)( )
| A. | 15种 | B. | 16种 | C. | 17种 | D. | 18种 |
9.以下有机物同分异构体数目判断中不正确的是( )
| A. | 立方烷( 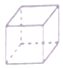 )的六氨基(-NH2)取代物有3种 )的六氨基(-NH2)取代物有3种 | |
| B. | C3H7ClO(有羟基)的同分异构体数目有5种 | |
| C. | 甲苯与氢气充分加成后的一溴代物有4种 | |
| D. | 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种 |
16.下列有关实验的选项正确的是( )
| A.配制0.10mol/LNaOH溶液 | B.观察Fe(OH)2的生成 | C.萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
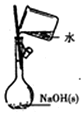 | 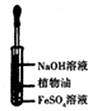 | 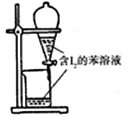 | 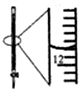 |
| A. | A | B. | B | C. | C | D. | D |
13.在一定条件下,X既能与Y反应又能与Z反应,且都属于复分解反应的是( )
| 选项 | X | Y | Z |
| A | Cu | HNO3 | Fe(NO3)3 |
| B | FeCl3 | Zn | NaHCO3 |
| C | O2 | NH3 | SO2 |
| D | NH4Al(SO4)2 | Ba(NO3)2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
17.下列说法中不正确的是( )
| A. | 常温下,向100gNaOH饱和溶液中加入0.39gNa2O2固体,恢复到常温,NaOH溶液的物质的量浓度一定不变 | |
| B. | 向一恒容容器中充入lmolN2和lmolH2,在一定条件下反应并达到平衡.升温,再次达到平衡状态,N2的体积分数一定不变 | |
| C. | 向50mL0.55mol/L的NaOH溶液中加入50mL0.50mol/L的稀盐酸,测定中和热,继续加入6mL等浓度的稀盐酸,测定的中和热一定不变 | |
| D. | 将2.3gNa投入100mL水中,产生H2,若在反应前向水中加入100 mL煤油,则产生H2的速率一定不变 |