题目内容
4.对于下列事实的解释错误的是( )| A. | 在蔗糖中加入浓硫酸后出现发黑的现象,说明浓硫酸具有脱水性 | |
| B. | Na的金属活动性比Mg强,说明可用Na与MgCl2溶液反应制Mg | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸反应生成了致密的氧化物 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘 |
分析 A.浓硫酸具有脱水性,可使蔗糖变黑;
B.金属钠和盐溶液的反应是先和其中的水反应;
C.铝与浓硝酸发生钝化作用;
D.碘不易溶于水,易溶于苯.
解答 解:A.浓硫酸具有脱水下,可使蔗糖脱水,碳化而变黑,故A正确;
B.金属钠和氯化镁盐溶液的反应是先和其中的水反应,不会置换出金属,故B错误;
C.铝与浓硝酸发生钝化作用,可在表面生成一层致密的氧化物膜而阻碍反应的继续进行,故C正确;
D.碘不易溶于水,易溶于苯,则向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘,故D正确.
故选B.
点评 本题考查较为综合,涉及浓硫酸、浓硝酸、钠以及萃取的原理,综合考查元素化合物知识,有利于培养学习的积极性和学生的科学素养,难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
14.反应A(g)+3B(g)═2C(g)+2D(g),在四种不同的情况下的反应速率v,其中反应进行最快的是( )
| A. | v(A)=0.2mol•(L•s)-1 | B. | v(C)=0.5 mol•(L•s)-1 | ||
| C. | v(B)=0.6 mol•(L•s)-1 | D. | v(D)=0.3 mol•(L•s)-1 |
15.CO2 分子中σ键与π键数目比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 1:3 |
12.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2H2S | B. | NH3 HCl | C. | P4 CCl4 | D. | C2H4 CH4 |
19.下列物质的熔、沸点高低顺序中,正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | I2>Br2>Cl2>F2 | ||
| C. | H2Te>H2Se>H2S>H2O | D. | 金刚石>CsCl>NaCl>钠 |
9.下列关于原子结构与元素性质的说法正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 全部由非金属元素组成的化合物中只含共价键 | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 |
16.下列物质能发生消去反应且产物只有一种的是( )
| A. | (CH3)3COH | B. | CH3OH | C. | CH3CHICH2CH3 | D. | (CH3)3C-CH2Cl |
13.已知 ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | X分子中所有碳原子一定在同一平面上 | |
| B. | X与乙烯不属于同系物 | |
| C. | Y可发生取代反应、氧化反应 | |
| D. | Y的含有相同官能团的同分异构体有8种(不考虑立体异构) |
19. 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,该反应能自发进行的条件是低温.(填“高温”、“低温”或“任意温度”).
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=0.10mol•Lˉ1•minˉ1.
②试计算该温度下反应Ⅳ的化学平衡常数 K=1.6.
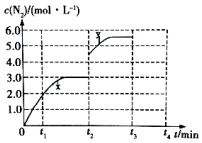
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L,c(N2)随时间 t 的变化曲线 x 如图所示.
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是快速将容器体积由3L压缩到2L.
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4内 c(N2)的变化曲线.
 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,该反应能自发进行的条件是低温.(填“高温”、“低温”或“任意温度”).
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
②试计算该温度下反应Ⅳ的化学平衡常数 K=1.6.
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L,c(N2)随时间 t 的变化曲线 x 如图所示.
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是快速将容器体积由3L压缩到2L.
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4内 c(N2)的变化曲线.