题目内容
9.有 NaCl、Na2CO3 和 NaHCO3 的混合物 4.00g,把它们加热到质量不再减少为止,冷却后称重为 3.38g,再向上述反应后的残留物中加入足量的盐酸,收集到 CO20.448L (标准状况).计算原混合物中Na2CO3 的物质的量.分析 加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,导致固体质量减少,利用差量法计算原混合物中NaHCO3的质量、生成碳酸钠的质量,利用反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据CO2的质量可计算加热后总的Na2CO3的质量,减去NaHCO3分解生成的Na2CO3的质量即可得原混合物中Na2CO3的质量.
解答 解:加热发生反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,导致固体质量减少:4g-3.38g=0.62g,
设混合物中有NaHCO3的质量为x,新生成的Na2CO3的质量为y,
2NaHCO3=Na2CO3+CO2↑+H2O△m
168g 106g 62g
x y 4g-3.38g=0.62g
解得x=$\frac{168g×0.62g}{62g}$=1.68g,y=$\frac{106g×0.62g}{62g}$=1.06g,
所以生成碳酸钠的物质的量为0.01mol,根据碳守恒原混合物中碳酸钠的物质的量为:$\frac{0.448L}{22.4L/mol}$-0.01mol=0.01mol,
答:原混合物中 Na2CO3 的物质的量为 0.01 mol.
点评 本题考查学生化学方程式的有关计算知识,题目难度中等,掌握碳酸钠、碳酸氢钠的化学性质为解答本题的关键,注意差量法在化学计算中的应用方法.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
20.下列叙述正确的是( )
| A. | 1 mol H3PO4的质量为98g.mol-1 | B. | H3PO4的摩尔质量为98 g | ||
| C. | 9.8 g H3PO4含有NA个H3PO4分子? | D. | NA个H3PO4分子的质量为98g |
17.X 元素最高价氧化物的水化物化学式为 H2XO4,则 X的气态氢化物的化学式为( )
| A. | XH4 | B. | XH3 | C. | H2X | D. | HX |
14.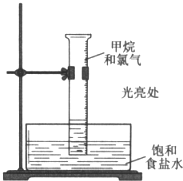 甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
 甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )| 现象 | 解释 | |
| A. | 量筒内气体颜色逐渐变浅 | 甲烷被氯气还原 |
| B. | 量筒内出现少量白雾 | 生成HCl气体 |
| C. | 量筒内壁产生油状液滴 | 油状液体是CCl4 |
| D. | 量筒中液面降低 | 生成液态产物 |
| A. | A | B. | B | C. | C | D. | D |
1.某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
反思与评价:
(1)步骤①反应的离子方程式为:2Br-+Cl2=Br2+2Cl-.
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色.
(3)你认为上述实验设计(填“能”或“不能”)不能达到实验目的,理由是①中所得黄色溶液中可能含有Cl2,会干扰Br2、I2氧化性的比较.
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
| 实验步骤 | 实验现象 | 实验结论 |
 | 溶液变为黄色 | 氧化性:Cl2>Br2 |
 | 溶液变为黄色 | 氧化性: Br2>I2 |
 | 溶液的颜色由黄色变为蓝色 |
(1)步骤①反应的离子方程式为:2Br-+Cl2=Br2+2Cl-.
(2)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)
向溶液中加入CCl4,振荡,静置,液体分为上下两层,下层呈紫红色.
(3)你认为上述实验设计(填“能”或“不能”)不能达到实验目的,理由是①中所得黄色溶液中可能含有Cl2,会干扰Br2、I2氧化性的比较.
18.电化学降解NO3-可治理硝酸盐的污染,原理如图所示.下列说法中不正确的是( )


| A. | 通电时阴极附近溶液的酸性增强 | |
| B. | 铅蓄电池的A极为正极 | |
| C. | 通电时,H+由左至右通过质子交换膜 | |
| D. | 通电时,Pt电极的质量几乎不变 |
19.0.5LFeCl3溶液中Cl-为9.03×1023个,则FeCl3溶液的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 1mol•L-1 | C. | 3mol•L-1 | D. | 1.5mol•L-1 |