题目内容
下列变化过程中,只破坏共价键的是( )
| A、冰变水 |
| B、将Na2SO4熔融呈液态 |
| C、HCl溶于水得盐酸 |
| D、从NH4HCO3中闻到了刺激性气味 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:
分析:A.冰是分子晶体,熔化为水时破坏氢键、分子间作用力;
B.Na2SO4属于离子化合物,熔融时电离破坏离子键;
C.HCl中含有共价键H-Cl,溶于水发生电离,破坏H-Cl;
D.从NH4HCO3中闻到了刺激性气味,NH4HCO3
NH3↑+CO2↑+H2O,破坏离子键和共价键.
B.Na2SO4属于离子化合物,熔融时电离破坏离子键;
C.HCl中含有共价键H-Cl,溶于水发生电离,破坏H-Cl;
D.从NH4HCO3中闻到了刺激性气味,NH4HCO3
| ||
解答:
解:A.冰是分子晶体,熔化为水时破坏氢键、分子间作用力,故A错误;
B.Na2SO4属于离子化合物,熔融时电离破坏离子键,故B错误;
C.HCl中含有共价键H-Cl,溶于水发生电离,破坏H-Cl,故C正确;
D.从NH4HCO3中闻到了刺激性气味,NH4HCO3
NH3↑+CO2↑+H2O,破坏离子键和共价键,故D错误;
故选C.
B.Na2SO4属于离子化合物,熔融时电离破坏离子键,故B错误;
C.HCl中含有共价键H-Cl,溶于水发生电离,破坏H-Cl,故C正确;
D.从NH4HCO3中闻到了刺激性气味,NH4HCO3
| ||
故选C.
点评:本题考查化学键与分子间作用力,难度不大,熟悉常见物质中的元素及元素之间的成键是解答本题的关键,注意铵盐中存在离子键来分析解答.

练习册系列答案
相关题目
仅用一种试剂鉴别苯酚溶液、己烷、己烯、乙醇4种物质,可选用的是( )
| A、FeCl3溶液 |
| B、浓溴水 |
| C、蒸馏水 |
| D、NaOH溶液 |
HF为一元弱酸,在0.1mol?L-1NaF溶液中,离子浓度关系不正确的是( )
| A、c(F-)>c(Na+)>c(OH-)>c(H+) |
| B、c(F-)+c(HF)=0.1mol?L-1 |
| C、c(OH-)=c(HF)+c(H+) |
| D、c(Na+)+c(H+)=c(F-)+c(OH-) |
如图所示的实验.下列说法不正确的是( )


| A、反应过程中产生的气泡是CO2 气体 |
| B、加入石灰石的目的是为了促进氯化铁水解 |
| C、最终所得红褐色液体为氢氧化铁胶体 |
| D、反应过程中产生的气泡是HCl 气体 |
下列物质的用途中,利用了物质的氧化性的是( )
| A、用漂白粉消毒游泳池中的水 |
| B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) |
| C、用食盐腌渍食物 |
| D、用小苏打治疗胃酸过多 |
用等体积的 1mol?L-1的BaCl2溶液,可使相同体积的Na2SO4、Fe2(SO4)3、KAl(SO4)2三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )
| A、1:3:2 |
| B、6:2:3 |
| C、1:1:1 |
| D、3:1:2 |

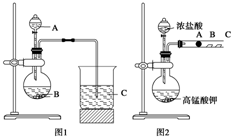 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.(已知高锰酸钾与浓盐酸反应生成氯气)
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.(已知高锰酸钾与浓盐酸反应生成氯气)