题目内容
X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)═Z(OH)2+H2↑;
④水溶液中,X+Y2+═X2++Y.
则这五种金属的活动性由强到弱的顺序为( )
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)═Z(OH)2+H2↑;
④水溶液中,X+Y2+═X2++Y.
则这五种金属的活动性由强到弱的顺序为( )
| A、Z>X>Y>M>N |
| B、Z>Y>X>M>N |
| C、Z>X>Y>N>M |
| D、X>Y>M>N>Z |
考点:常见金属的活动性顺序及其应用
专题:几种重要的金属及其化合物
分析:①原电池的负极金属活泼性强于正极金属的活泼性;
②原电池的负极金属活泼性强于正极金属的活泼性,电子从负极流向正极;
③活泼金属钾、钙、钠可和冷水之间反应产生氢气;
④活泼金属可以将较不活泼金属从其盐中置换出来.
②原电池的负极金属活泼性强于正极金属的活泼性,电子从负极流向正极;
③活泼金属钾、钙、钠可和冷水之间反应产生氢气;
④活泼金属可以将较不活泼金属从其盐中置换出来.
解答:
解:①Y与M用导线连接放入稀硫酸中,M上冒气泡,则M是正极,Y是负极,原电池的负极金属活泼性强于正极金属的活泼性,即Y>M;
②M、N为电极,与N的盐溶液组成原电池,电子从负极M极流出,经过外电路,流入正极N极,负极金属活泼性强于正极金属的活泼性,即M>N;
③活泼金属钾、钙、钠可和冷水之间反应产生氢气,所以Z是活泼金属;
④X+Y2+═X2++Y,活泼金属可以将较不活泼金属从其盐中置换出来,所以X>Y.
综上知道:五种金属的活动性由强到弱的顺序:Z>X>Y>M>N.
故选A.
②M、N为电极,与N的盐溶液组成原电池,电子从负极M极流出,经过外电路,流入正极N极,负极金属活泼性强于正极金属的活泼性,即M>N;
③活泼金属钾、钙、钠可和冷水之间反应产生氢气,所以Z是活泼金属;
④X+Y2+═X2++Y,活泼金属可以将较不活泼金属从其盐中置换出来,所以X>Y.
综上知道:五种金属的活动性由强到弱的顺序:Z>X>Y>M>N.
故选A.
点评:能与水反应置换出水中H元素的金属活动性较强,能置换出盐溶液中金属元素的金属,其活动性比盐中金属活动性强,原电池的负极金属活泼性强于正极.

练习册系列答案
相关题目
将镁带投入盛放在敞口容器内的盐酸里,反应速率用产生的氢气的速率表示,在下列因素中:
①盐酸的浓度,
②镁带的表面积,
③溶液的温度,
④盐酸的体积,
⑤氯离子的浓度,
其中影响反应速率的因素是( )
①盐酸的浓度,
②镁带的表面积,
③溶液的温度,
④盐酸的体积,
⑤氯离子的浓度,
其中影响反应速率的因素是( )
| A、①④ | B、③⑤ |
| C、①②③⑤ | D、①②③ |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
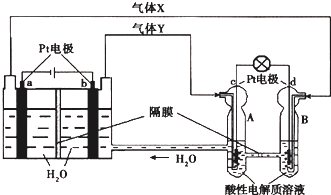

| A、当有0.1mol电子转移时,a极产生0.56L O2(标准状况下) |
| B、为了增加导电性可以将左边容器中的水改为食盐水 |
| C、c极上进行还原反应,B中的H+可以通过隔膜进入A |
| D、d极上发生的电极反应是:O2+4H++4e-═2H2O |
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是( )
| A、a原子的最外层电子数比b原子的最外层电子数少 |
| B、把a、b两块金属片浸入稀硫酸中,用导线相连组成原电池时,电流由 a到b |
| C、1mol a从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多 |
| D、常温时,a能从水中置换出氢,而b不能 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B、28g乙烯所含共用电子对数目为4NA |
| C、1mol甲基的电子数目为7NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
下列有关能量的说法不正确的是( )
| A、化石能源物质内部贮存着大量的能量 |
| B、植物的光合作用使太阳能转化为化学能 |
| C、燃料燃烧时只是将化学能转化为热能 |
| D、由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低 |
下列有关晶体的说法中一定正确的是( )
①依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体;
②由原子直接构成的晶体就是原子晶体;
③分子晶体的堆积均采取分子密堆积;
④NaF、MgF2、SiF4三种晶体的熔点依次升高;
⑤金属键只存在于金属晶体中;
⑥离子键只存在于离子晶体中;
⑦H2O的性质非常稳定,原因在于分子之间存在氢键;
⑧SO2和SiO2晶体在熔化时破坏的作用力相同.
①依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体;
②由原子直接构成的晶体就是原子晶体;
③分子晶体的堆积均采取分子密堆积;
④NaF、MgF2、SiF4三种晶体的熔点依次升高;
⑤金属键只存在于金属晶体中;
⑥离子键只存在于离子晶体中;
⑦H2O的性质非常稳定,原因在于分子之间存在氢键;
⑧SO2和SiO2晶体在熔化时破坏的作用力相同.
| A、①⑤⑥⑦ | B、只有⑥ |
| C、②③⑤⑥ | D、①②⑤⑧ |
下列有关碱金属的叙述正确的是( )
| A、碱金属都可以保存在煤油中 |
| B、碱金属的金属性强弱为:Li<Na<K<Rb |
| C、随着原子序数的增加,碱金属的熔点增大 |
| D、碱金属着火应用泡沫灭火剂更好 |
下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A、它们的氢化物的稳定性随核电荷数的增加而增强 |
| B、它们单质的氧化性依次减弱 |
| C、它们的原子核外电子层数随核电荷数的增加而增多 |
| D、单质的颜色随核电荷数的增加而加深 |